
【题目】某同学利用下图的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。
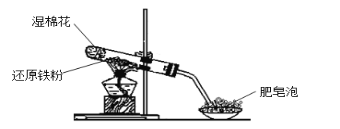
请回答下列问题:
(1)图中湿棉花的作用是____________;硬质试管中发生反应的化学方程式为__________ 。
(2)该同学推测反应后硬质试管中固体物质的成分有两种可能性:ⅰ只有Fe3O4 ,ⅱFe3O4和Fe都有;并设计了如下实验方案验证:
①待硬质试管冷却后,将固体磨碎后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,溶液未变红色,则说明硬质试管中固体物质的成分是____。溶液未变红色的主要原因是:______(用离子方程式表示)。
(3)该同学马上另取少量溶液B于试管中,按下图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出上述白色沉淀变成红褐色的化学方程式:_______。
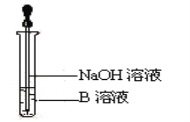
(4)该同学向②的溶液中加入几滴氯水溶液变成红色,说明Fe2+具有______性。
【答案】提供水蒸气 3Fe+4H2O(g) ![]() Fe3O4+4H2 Fe3O4和Fe 2Fe3++Fe=3Fe2+ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 还原
Fe3O4+4H2 Fe3O4和Fe 2Fe3++Fe=3Fe2+ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 还原
【解析】
(1)硬质试管中中铁与湿棉花加热产生的水蒸气反应生成四氧化三铁和氢气;
(2)KSCN溶液遇Fe3+变红色,溶液未变红色,不变红色说明无Fe3+,铁单质能将+3价的Fe3+还原成+2价的Fe2+;
(3)溶液B中滴入NaOH溶液时,生成的白色沉淀迅速变成灰绿色,最后变成红褐色,说明溶液中含有Fe2+,首先生成Fe(OH)2白色沉淀,Fe(OH)2会被氧化产生红褐色的Fe(OH)3;
(4)向②的溶液中加入氯水,溶液变为红色,说明Fe2+被氯水氧化为Fe3+,Fe3+与SCN-反应产生红色物质。
(1)湿棉花上有水分,加热会产生水蒸气,与硬质试管中铁在高温下发生反应产生Fe3O4和H2,反应的方程式为:3Fe+4H2O(g) ![]() Fe3O4+4H2;
Fe3O4+4H2;
(2)①待硬质试管冷却后,将固体磨碎,取少许其中的固体物质溶于稀硫酸得溶液B;②取少量溶液B滴加KSCN溶液,溶液未变红色,则说明硬质试管中固体物质的成分是Fe3O4和Fe,溶液未变红色的主要原因是铁单质能将+3价的Fe3+还原成+2价的Fe2+,反应的离子方程为:Fe+2Fe3+=3Fe2+;
(3)向用硫酸溶解反应得到的固体后的溶液B中滴入NaOH溶液时,生成的白色沉淀,白色沉淀迅速变成灰绿色,最后变成红褐色,该反应为FeSO4+2NaOH=Fe(OH)2↓+Na2SO4;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)向②的溶液中加入氯水,溶液变为红色,说明Fe2+与氯水作用产生了Fe3+,Fe3+与SCN-反应产生红色物质,Fe元素由+2价变为+3价,化合价升高,失去电子,被氧化,因此Fe2+表现还原性。


科目:高中化学 来源: 题型:
【题目】以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关的计算正确的是( )
A.a g Cl2中有b个氯原子,则阿伏加德罗常数NA的数值可表示为71b/a
B.5.6 g CO和22.4 L CO2中含有的碳原子数一定相等
C.将20 g NaOH固体溶解在500 mL水中所得溶液的物质的量浓度为1 mol·L-1
D.现有等物质的量的CO和CO2,这两种气体中氧原子的质量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡椒酚是植物挥发油中的一种成分(结构如图所示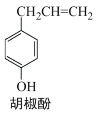 )。关于胡椒酚的下列说法:
)。关于胡椒酚的下列说法:
①该化合物属于芳香烃;
②分子中至少有7个碳原子处于同一平面内;
③它不能与烧碱发生反应;
④1mol该化合物最多可与 3molBr2发生反应。其中正确的是( )
A.①③B.①②④C.②④D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作完全正确的是()
编号 | 实验 | 操作 |
A | 用浓硫酸配制一定浓度的稀硫酸 | 准确量取浓硫酸,将浓硫酸溶于水后,立刻转移到容量瓶中。 |
B | 制取氢氧化亚铁沉淀 |
|
C | 量取盐酸溶液 | 用50 mL量筒量取4.0 mol/L的盐酸5.62 mL |
D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物M 7.4 g与足量氧气反应后,所得气体依次通过盛有浓H2SO4和碱石灰的装置,两装置分别增重9 g和17.6 g;同温同压下,M蒸汽的密度是H2的37倍,则能够与钠反应放出H2的M的同分异构体的数目(不考虑立体异构)
A.8 B.6 C.4 D.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于0.1mol/LH2SO4溶液的叙述错误的是
A.1L该溶液中含有H2SO4的质量为9.8g
B.0.5L该溶液中氢离子的物质的量浓度为0.2mol/L
C.从1L该溶液中取出100mL,则取出的溶液中H2SO4的物质的量浓度为0.01mol/L
D.取该溶液10mL加水稀释至100mL后,H2SO4的物质的量浓度为0.01mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炼油厂烷基化反应产生的废液中含硫酸91%、难挥发有机物7%。实验室以软锰矿(主要含MnO2,还含少量Fe、Al等元素)处理废液并制取MnSO4·H2O晶体,其实验流程如图:
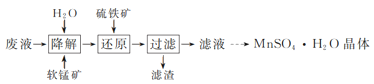
(1)研究温度对“降解”过程中有机物去除率的影响,实验在如图1所示的装置中进行。
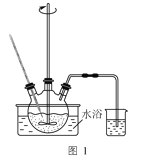
①在不同温度下反应相同时间,发现温度从60℃升高到95℃时,有机物去除率从29%增大到58%,其可能的原因是:MnO2的氧化能力随温度升高而增强;__。
②废液因含有机物而呈现黑红色。有机物降解速率慢,难以观察气泡产生速率。降解一段时间,判断有机物浓度基本不变的依据是:三颈烧瓶内__。烧杯中盛放的试剂可以是__。
(2)降解一段时间后,加入硫铁矿(主要成分FeS2)将剩余MnO2还原,所得溶液中的主要离子有Fe3+、Mn2+、SO42-等,其离子方程式为__。
(3)滤液若用足量高纯度MnO2再次氧化降解,改变条件,有机物去除率可达66%。反应后过滤,所得滤渣经洗涤后,在本实验流程中可用于__。
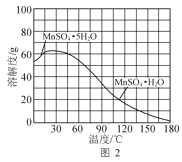
(4)MnSO4·H2O的溶解度曲线如图2所示。设计以过滤所得滤液为原料,进一步除去有机物等杂质并制取MnSO4·H2O晶体的实验方案:__,趁热过滤,用热的硫酸锰溶液洗涤,150℃烘干。[已知pH=5时Fe(OH)3和Al(OH)3沉淀完全;MnSO4·H2O分解温度为200℃。实验中必须使用的试剂:石灰石粉末、活性炭]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有溴水的三支试管中分别加入汽油、四氯化碳和酒精,振荡后静置,出现如图所示的现象。下列说法正确的是( )

A.①加入的是CCl4,②加入的是汽油,③加入的是酒精
B.①加入的是酒精,②加入的是CCl4,③加入的是汽油
C.①加入的是汽油,②加入的是酒精,③加入的是CCl4
D.①加入的是汽油,②加入的是CCl4,③加入的是酒精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究废旧电池的再利用,实验室利用旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO的部分实验过程如图所示。下列叙述错误的是
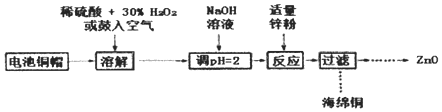
A.“溶解”操作中溶液温度不宜过髙
B.铜帽溶解的反应可能有H2O2+Cu+2H+=Cu2++2H2O
C.与锌粉反应的离子可能是Cu2+、H+
D.“过滤”操作后,将滤液蒸发结晶、过滤、洗涤、干燥后高温灼烧即可得纯净的ZnO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com