
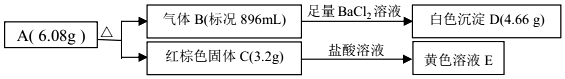
分析 n(B)=$\frac{0.896ml}{22.4l/mol}$=0.04mol,生成白色沉淀D为BaSO4,且n(BaSO4)=$\frac{4.66g}{233g/mol}$=0.02mol,说明n(SO3)=0.02mol,红综合固体为Fe2O3,n(Fe2O3)=$\frac{3.2g}{160g/mol}$=0.02mol,说明A含有Fe、S、O等元素,B中还含有SO2,且n(SO2)=0.02mol,以此解答该题.
解答 解:n(B)=$\frac{0.896ml}{22.4l/mol}$=0.04mol,生成白色沉淀D为BaSO4,且n(BaSO4)=$\frac{4.66g}{233g/mol}$=0.02mol,说明n(SO3)=0.02mol,红综合固体为Fe2O3,n(Fe2O3)=$\frac{3.2g}{160g/mol}$=0.02mol,说明A含有Fe、S、O等元素,B中还含有SO2,且n(SO2)=0.02mol,
(1)由以上分析可知C为Fe2O3,
故答案为:Fe2O3;
(2)由以上分析可知n(SO3)=0.02mol,n(SO2)=0.02mol,n(Fe2O3)=0.02mol,且m(SO3)+m(SO2)+m(Fe2O3)=0.02mol×80g/mol+0.02mol×64g/mol+3.2g=6.08g,说明A中n(Fe):n(S):n(O)=1:1:4,A为FeSO4,分解的方程式为2FeSO4$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+SO3↑+SO2↑,
故答案为:2FeSO4$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+SO3↑+SO2↑;
(3)气体 B 为二氧化硫和三氧化硫,与溶液 E为氯化铁溶液 反应,发生氧化还原反应生成氯化亚铁、硫酸,反应的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
点评 本题考查无机物的推断以及物质的组成的判断,为高频考点,把握二氧化硫的性质、铁离子检验为解答的关键,侧重分析与推断能力的考查,注意从质量守恒的角度判断A的化学式,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | m+n>p | B. | 平衡向逆反应方向移动 | ||
| C. | A的转化率减小 | D. | C的体积分数增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | P-P | P-O | O═O | P═O |
| 键能/kJ•mol-1 | a | b | c | x |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 许多含碳、含氢物质是重要的化工原料.
许多含碳、含氢物质是重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时Li+由正极向负极移动 | |
| B. | M可能为羧酸、醇等含活泼氢的有机物 | |
| C. | 充电时的阳极反应为LixC-xe-=C+xLi+ | |
| D. | 钾离子电池的比能量(单位质量释放的能量)低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食用醋就是冰醋酸 | B. | 医用酒精浓度为75% | ||
| C. | 钢铁生锈主要是发生了析氢腐蚀 | D. | 汽车尾气的排放会引起臭氧空洞 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol/L的氨水中有0.1NA个NH4+ | |
| B. | 17 g H2O2中含有8NA个电子 | |
| C. | 7.8g Na2S和7.8g Na2O2所含离子数相等,均为0.3 NA | |
| D. | 标准状况下,22.4LNO与11.2LO2混合后气体的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油产品--直馏汽油和裂化汽油的成分相同 | |
| B. | 获得上述化石能源的过程均为化学变化 | |
| C. | 水煤气是通过煤的液化得到的气体燃料 | |
| D. | 天然气是一种清洁能源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com