
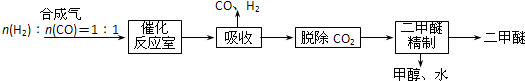
分析 Ⅰ、(1)依据自发进行的判断依据为△H-T△S<0,是自发进行的反应;△H-T△S>0,是非自发进行的反应;
(2)依据热化学方程式和盖斯定律计算得到热化学方程式进行计算应用;催化反应室内的反应条件是压力2.0~10.0Mpa,温度230~280℃;结合化学平衡影响因素分析判断;
(3)依据反应过程中的中间产物是可以循环利用的物质;
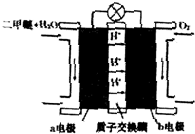
Ⅱ、反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,b为正极,氧气在正极放电.由图可知,a极为负极,二甲醚放电生成二氧化碳与氢离子.
解答 解:I.(1)甲烷氧化可制合成气:CH4(g)+$\frac{1}{2}$O2(g)?CO(g)+2H2(g)△H=-35.6kJ/mol,△S>0,△H<0,;△H-T△S<0,反应能自发进行,
故答案为:自发;
(2)催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应.
①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ/mol
依据盖斯定律①×2+②+③得到:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-246.1kJ/mol;
830℃时反应③的K=1.0,则在催化反应室中,压力2.0~10.0Mpa,温度230~280℃,温度降低.平衡正向进行,反应③的K增大;
故答案为:-246.1kJ/mol;>;
(3)依据催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应.
①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ/mol
CO、甲醇和水,是中间产物,H2也可以部分循环,
故答案为:CO、H2、甲醇和水;
II.反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,氧气在正极放电.由图可知,a极为负极,二甲醚放电生成二氧化碳与氢离子,a电极的电极反应式为 CH3OCH3-12e-+3H2O=2CO2+12H+,b为正极,氧气得到电子发生还原反应,
故答案为:正.
点评 本题考查了反应自发进行的判断依据,盖斯定律的计算应用,平衡影响因素的分析判断,原电池的电极判断,电极反应书写应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 由 1 mol CuFeS2 生成 1mol Cu,共消耗 2.75 molO2 | |
| B. | 该冶炼方法中产生大量的有害气体SO2,可回收用于制备硫酸 | |
| C. | 在反应③中,Cu2S既是氧化剂,又是还原剂 | |
| D. | 在反应①中,SO2既是氧化产物,又是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
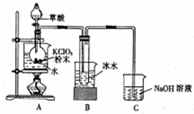 二氧化氯是一种高效消毒剂,在60℃时用氯酸钾与草酸反应可生成二氧化氯,实验装置如图所示:
二氧化氯是一种高效消毒剂,在60℃时用氯酸钾与草酸反应可生成二氧化氯,实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.| 滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
| 第一次 | 0.00 | 30.82 |
| 第二次 | 0.00 | 30.80 |
| 第三次 | 0.00 | 30.78 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
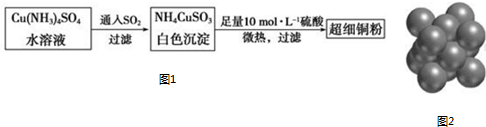
 ; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为N>O>S(填元素符号).
; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为N>O>S(填元素符号).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
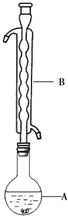
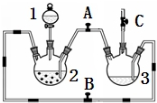 某化学兴趣小组拟用如图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁屑、稀硫酸、氢氧化钠溶液.
某化学兴趣小组拟用如图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁屑、稀硫酸、氢氧化钠溶液.| 实验次数 | 第一次 | 第二次来 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
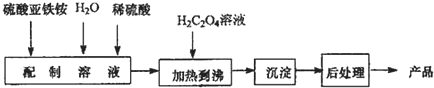
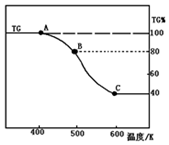
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
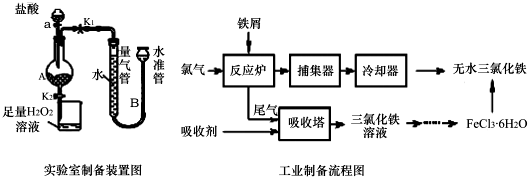
| 温度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| B. | 过氧化钠溶于水:2022-+2H2O═4OH-+O2↑ | |
| C. | 将过量二氧化硫气体通入氨水中:SO2+NH3•H2O═HSO3-+NH4+ | |
| D. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com