
按不同的分类法,下列每组都有一种物质与其他物质不同,试分析每组中物质的组成规律,将其中不同于其他物质的物质找出来
(1)NaCl、KCl、NaClO、BaCl2 ;
(2)HClO3、KClO3、Cl2、NaClO3 ;
(3)H3PO4、H4SiO4、HCl、H2SO4 ;
(4)空气、N2、HCl气体、CuSO4•5H2O ;
(5)铜、金、汞、钠 .
考点:酸、碱、盐、氧化物的概念及其相互联系;混合物和纯净物.
专题:物质的分类专题.
分析:(1)根据盐的分类依据分析;(2)根据单质和化合物的定义判断;(3)从酸的分类依据分析;(4)从纯净物、混合物的或状态分析;(5)从金属活泼性或状态分析.
解答: 解:(1)NaCl、KCl、BaCl2为盐酸盐,NaClO为次氯酸盐;NaCl、KCl、NaClO为轻金属盐,BaCl2为重金属盐;NaCl、KCl、BaCl2为不含氧盐,NaClO为含氧盐,
故答案为:NaClO或BaCl2;
(2)HClO3、KClO3、NaClO3 属于化合物,Cl2属于单质,故答案为:Cl2;
(3)从是否含氧的角度分类:HCl属于无氧酸,H3PO4、H4SiO4、H2SO4属于含氧酸,故答案为:HCl;从溶解性分类:H3PO4、HCl、H2SO4属于可溶性酸,H4SiO4属于不溶性酸,故答案为:HCl或H4SiO4;
(4)空气为混合物,N2、HCl气体、CuSO4•5H2O为纯净物;根据状态分析,空气、N2、HCl气体为气态、CuSO4•5H2O为固态,故答案为:空气或CuSO4•5H2O;
(5)Na属于活泼金属,铜、金、银属于不活泼金属,根据铜、金、钠为固态,汞为液态,故答案为:钠或汞.
点评:本题考查物质的分类,题目难度不大,注意酸、碱、盐以及氧化物,的概念的区别和联纯净物和混合物、单质和化合物的区别联系.


科目:高中化学 来源: 题型:
下列事实中,不能用勒夏特列原理解释的是( )
A.开启啤酒后,瓶中马上泛起大量泡沫
B.钢铁在潮湿的空气中容易生锈
C.实验室中常用排饱和食盐水的方法收集氯气
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案、现象和结论均正确的是( )
选项 实验方案 现象 结论
A 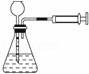 向里推活塞时,长颈漏斗中有一段水柱,静止,水柱高度不变 该装置的气密性良好
向里推活塞时,长颈漏斗中有一段水柱,静止,水柱高度不变 该装置的气密性良好
B 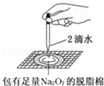 脱脂棉燃烧 Na2O2与水反应生成氢氧化钠和氧气
脱脂棉燃烧 Na2O2与水反应生成氢氧化钠和氧气
C 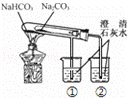 烧杯①的澄清石灰水先变浑浊 NaHCO3比Na2CO3受热更易分解
烧杯①的澄清石灰水先变浑浊 NaHCO3比Na2CO3受热更易分解
D 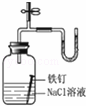 U形管右端的液面高 铁钉发生吸氧腐蚀
U形管右端的液面高 铁钉发生吸氧腐蚀
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
化学概念在逻辑上存在如图所示关系,对下列概念间的关系说法正确的是( )

A.纯净物与混合物属于包含关系
B.化合物与电解质属于包含关系
C.单质与化合物属于交叉关系
D.氧化反应与化合反应属于并列关系
查看答案和解析>>
科目:高中化学 来源: 题型:
关于1mol•1﹣1的Na2SO4溶液的叙述正确的是( )
A.溶液中含1molNa2SO4
B.Na+的浓度为1mol•1﹣1
C.配制时,将1molNa2SO4溶于1L水中
D.将322gNa2SO4•10H2O溶于少量水后再稀释成1000mL,即配制成相应溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质分类或归类正确的是( )
①混合物:石炭酸、福尔马林、水玻璃、水银
②化合物:CaCl2、烧碱、聚苯乙烯、HD
③电解质:明矾、胆矾、冰醋酸、硫酸钡
④同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
⑤同素异形体:C60、C70、金刚石、石墨.
|
| A. | ①③④ | B. | ③⑤ | C. | ②③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
光谱研究表明,易溶于水的S02所形成的溶液中存在着下列平衡:
据此,下列判断中正确的是( )
|
| A. | 该溶液中存在着SO2分子 |
|
| B. | 该溶液中H+浓度是SO32﹣浓度的2倍 |
|
| C. | 向该溶液中加入足量的酸都能放出SO2气体 |
|
| D. | 向该溶液中加入过量NaOH可得到Na2SO3、NaHSO3和NaOH的混合溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组设想将少量Cl2通入Fe2+和I﹣的混合溶液中,探究Fe2+和I﹣的还原性强弱.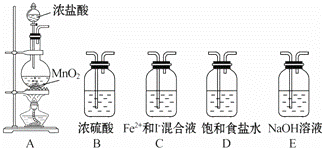
【提出假设】假设1:Fe2+还原性比I﹣强. 假设2:I﹣还原性比Fe2+强.
【验证假设】选择几种装置进行实验:
(1)实验必需的装置是A→ (按Cl2气流方向的顺序填写)
(2)实验开始后,控制通入氯气的量,当通入少量氯气时,通过观察混合溶液颜色的变化 (填“能”或“不能”)判断反应的先后顺序.
(3)请在下表中写出实验步骤及预期现象和结论.
| 实验步骤 | 预期现象和结论 |
| 取少量反应后的混合溶液分置于A、B两试管中: 往A中滴加 溶液; 往B中滴加 溶液. | ①A: , ②B: , 则假设1成立. ③A: ④B: , 则假设2成立. |
(4)为了实验成功,必须控制各物质的量.该小组称取1.52g FeSO4固体,同时称取1.66g KI固体,溶于水中配成混合溶液.为了验证上述假设,通入的Cl2体积最多不能超过 L(标准状况).
【思考与交流】
(5)有同学质疑,上述实验中Cl2量很难控制,无法验证Fe2+和I﹣反应的先后顺序.于是提出另一方案:往KI溶液中滴入 溶液,若能发生反应,即可证明I﹣的还原性强于Fe2+.
查看答案和解析>>
科目:高中化学 来源: 题型:
关于甲、乙装置的下列叙述中正确的是()
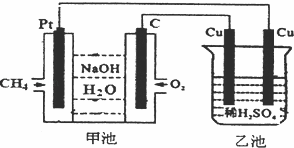
A. 甲池中通甲烷的极是负极,溶液中Na+向Pt电极移动
B. C电极的电极反应为:O2+4e﹣+4H+═2H2O
C. 乙池中的总反应为:Cu+H2SO4 H2↑+CuSO4
H2↑+CuSO4
D. 反应过程中,甲、乙装置中溶液的pH都逐渐减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com