
实验室制备,收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器口顺序为a接( )接( )接( )接( )接f(填接口字母) ( )

A.b c d e B.d e b c C.d e c b D.e d b c
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源:2013-2014河南省周口市高一下学期6月联考化学试卷(解析版) 题型:选择题
已知反应: 为放热反应,一定温度下在密闭容器中进行反应,
为放热反应,一定温度下在密闭容器中进行反应,
下图是该反应达平衡及改变条件平衡移动的图像。下列说法正确的是

A.图中的a、b、c、d都是平衡点
B.起始时,加入Y的物质的量为1.3 mol ,
C.c点和d点表示正反应速率大于逆反应速率
D.在3 MPa和1 MPa条件下,反应达平衡时,放出的热量:Q(A)>Q(B)
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省南阳市春期高二期终质量评估化学试卷(解析版) 题型:选择题
右图有机物分子中带“*”碳原子是手性碳原子。该有机物分别发生下列反应,生成的有机物分子中不会含有手性碳原子的是 
①.与甲酸发生酯化反应 ②.与足量NaOH水溶液反应
③.与银氨溶液作用只发生银镜反应 ④.催化剂作用下与H2反应
A.①②③④ B.①③ C.②④ D.以上反应都不成立
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省南阳市春期高一期终质量评估化学试卷(解析版) 题型:填空题
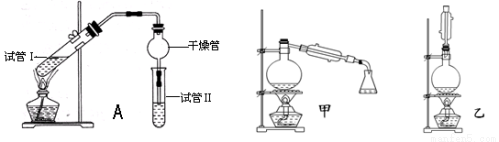
(14分)乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用下图A装置制备乙酸乙酯.
(1)若实验中用乙酸和含18O的乙醇作用,该反应的化学方程式是:
与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是 .
(2)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层的厚度/cm |
A | 2mL乙醇、1mL乙酸、 | 饱和Na2CO3溶液 | 3.0 |
B | 2mL乙醇、1mL乙酸 | 0.1 | |
C | 2mL乙醇、1mL乙酸、 | 0.6 | |
D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是 mL和 mol?L-1.
②分析实验 (填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.
(3)若现有乙酸90g,乙醇138g发生酯化反应得到88g乙酸乙酯,试计算该反应的产率为 .
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,如图是分离操作步骤流程图.图中( )内为适当的试剂,【 】内为适当的分离方法.
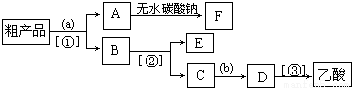
①试剂a是 ;分离方法②是 ,分离方法③是 .分离方法①是分液,在具体操作中应充分振荡,然后静置,待分层后 (填标号),
A.直接将乙酸乙酯从分液漏斗上口倒出
B.直接将乙酸乙酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸乙酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸乙酯从上口放出
②在得到的A中加入无水碳酸钠粉末,振荡,目的是 .
(5)为充分利用反应物,甲、乙两位同学分别设计了上面图中甲、乙两个装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物).你认为最合理的是
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省南阳市春期高一期终质量评估化学试卷(解析版) 题型:选择题
下列关于苯的叙述正确的是
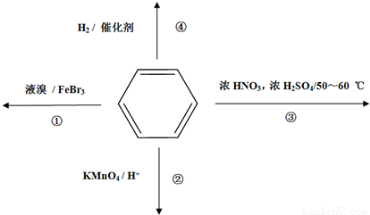
A.反应①常温下能进行,其有机产物为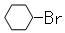
B.反应②不发生,但是仍有分层现象,紫色层在下层
C.反应③为加成反应,产物是三硝基甲苯
D.反应 ④中1mol苯最多与3 mol H2发生加成反应,是因为苯分子含有三个碳碳双键
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省南阳市春期高一期终质量评估化学试卷(解析版) 题型:选择题
下表物质与其所含化学键类型、所属化合物类型完全正确的一组是
选 项 | A | B | C | D |
物 质 | CO2 | MgCl2 | HCl | NaOH |
所含化学键类型 | 共价键 | 离子键、共价键 | 离子键 | 离子键、共价键 |
所属化合物类型 | 共价化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省六市毕业班第二次联合调研检测理综化学试卷(解析版) 题型:填空题
(14分)金属钛素有“太空金属”、“未来金属”等美誉。工业上,以钛铁矿为原料制备二氧化钛并得到副产品FeSO4·7H2O(绿矾)的工艺流程如下图所示。
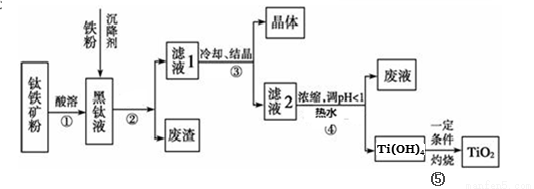
已知:TiO2+在一定条件下会发生水解;钛铁矿主要成分为钛酸亚铁(FeTiO3),含有少量SiO2杂质;其中一部分铁元素在钛铁矿处理过程中会转化为+3价。
(1)黑钛液中生成的主要阳离子有TiO2+和Fe2+,写出步骤①化学反应方程式:_________;
步骤②中,加入铁粉的主要目的是 。
(2)步骤③中,实现混合物的分离是利用物质的 (填字母序号)。
a.熔沸点差异 b.溶解性差异 c.氧化性、还原性差异
(3)步骤②、③、④中,均涉及到的操作是 (填操作名称);在实验室完成步骤⑤“灼 烧”所需主要仪器有 。
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为Ti(OH)4 的原因:
。
(5)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),该反应的离子方程式为 。
(6)实验室通过下面方法可测定副产品绿矾中FeSO4·7H2O的质量分数。
a.称取2.85g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为19.00mL(滴定时发生反应的离子方程式为:Fe2++MnO4-+H+→Fe3++Mn2++H2O 未配平 )。
计算上述样品中FeSO4·7H2O的质量分数为 (用小数表示,保留二位小数)。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南师大附中高三4月份月考理综化学试卷(解析版) 题型:选择题
萤火虫发光前后物质的变化如下:

下列关于荧光素和氧化荧光素的叙述不正确的是
A.二者的分子组成相差一个CHO
B. 二者的分子组成相差一个CH2O
C.都能使酸性KMnO4溶液褪色
D.都既能发生加成反应又能发生取代反应
查看答案和解析>>
科目:高中化学 来源:2013-2014河北省高二下学期第三次月考化学试卷(解析版) 题型:选择题
相对分子质量为300以下的某脂肪酸1.0g与2.7g碘恰好完全加成,也可被0.2gKOH中和,由此计算该脂肪酸的相对分子质量是( )
A.274 B.278 C.280 D.282
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com