
【题目】将0.4gNaOH和1.06g![]() 混合并配成溶液,向溶液中滴加0.1mol·
混合并配成溶液,向溶液中滴加0.1mol·![]() 稀盐酸。下列图像能正确表示加入盐酸的体积和生成
稀盐酸。下列图像能正确表示加入盐酸的体积和生成![]() 的物质的量的关系的是( )
的物质的量的关系的是( )
科目:高中化学 来源: 题型:
【题目】高三一年的化学复习,学生要抓住两方面,一方面是教材,另一方面是历年的高考真题。每年的高考题,在教材中几乎都能找到影子,所以同学一定要紧紧抓住教材,根据《必修一》第三章和第四章的内容回答下列问题:
(1)实验3-1是取用钠单质的实验,用品有小刀, 、 、培养皿。
(2)金属铝及其化合物在日常的生产生活中,用途很广泛,氧化铝的用途 (举一例)。 氢氧化铝的用途 (举一例)。
(3)印刷铜箔电路板常用FeCl3溶液作为腐蚀液,写出反应的离子方程式 。
(4)漂白粉或漂粉精失效的原理为(请用化学方程式表示): 、 。
(5)石灰法是目前应用最广泛的工业废气脱硫法,过程如下:通过煅烧石灰石得到生石灰,以生石灰为脱硫剂,在吸收塔中与废气中的SO2反应而将硫固定,其产物可用作建筑材料。有关的反应化学方程式为:CaCO3![]() CaO + CO2 、 。
CaO + CO2 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的容器中放入4mol N2O5,发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g)。反应进行到5min时,测得N2O5转化了20%,
4NO2(g)+O2(g)。反应进行到5min时,测得N2O5转化了20%,
(1)5min时,剩余N2O5的物质的量;
(2)前5min,v(NO2)为多少;
(3)5min时,N2O5的物质的量占混合气体总物质的量的百分比(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I (1)某同学做如下实验,以检验反应中的能量变化。
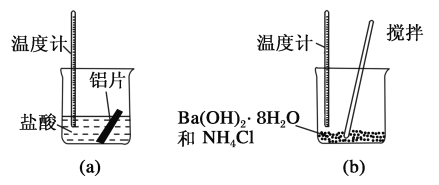
实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是__________热反应;
(b)中温度降低, 根据能量守恒定律,(b)中反应物的总能量应该__________其生成物的总能量。
(2) 下列反应:①氢氧化钠与硫酸,②一氧化碳与氧气,
③八水合氢氧化钡与氯化铵,④金属铜与硝酸银。
其中(用序号填空): 能设计成原电池的反应是____________________。
II(1)有下列几种物质
A.金刚石和石墨 B.C2H6和C5H12 C. C2H4 和 C2H6
D.CH3CH2CH2CH3 和 CH3CH(CH3)2 E.35Cl和37Cl
属于同分异构体的是________;属于同素异形体的是________;
属于同系物的是________; 属于同位素的是________。
(2) 两种粒子的核外电子排布相同,核电荷数不同,则它们可能是________。
A.两种不同元素的原子 B.一定是两种不同的离子
C.同一元素的原子和离子 D.两种不同元素的原子和离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是A、B、C、D、E五种有机物的有关信息:
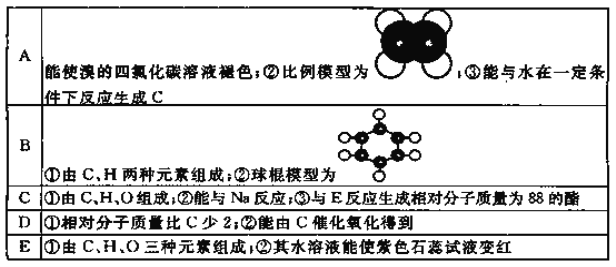
回答下列问题:
(1) A~E中,属于烃的是_____________(填字母)。
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为___________________。
(3)有机物B具有的性质是_______________________(填序号)。
①无色无味的液体; ②有毒; ③不溶于水; ④密度比水大; ⑤能使酸性KMnO4溶液和溴水褪色
(4)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是:____________________(用化学方程式说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如下图所示的装置:
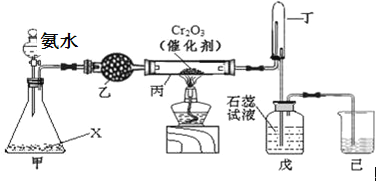
(1)若分液漏斗中氨水的浓度为9.0molL﹣1,配制该浓度的氨水100mL,用到的玻璃仪器有100mL容量瓶、烧杯、玻璃棒、 。
(2)甲装置不需要加热即能同时产生氨气和氧气,烧瓶内固体X的名称为 。
(3)乙装置的作用是 ;写出受热时丙装置发生反应的化学方程式为 。
(4)当戊中观察到 现象,则说明已制得硝酸。某同学按上图组装仪器并检验气密性后进行实验,没有观察到此现象,请分析实验失败的可能原因 。如何改进置 。
(5)改进后待反应结束,将丁装置倒立在盛水的水槽中,会观察到的现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素a、b、c、d的原子序数依次增大,c和d位于同主族且原子序数相差8;基态a原子核外有3个能级上容纳电子且每个能级上电子数相等,c原子s能级电子总数与p能级电子数相等,基态e原子的M层上有2个未成对电子且无空轨道。
(1)在a、b、c中,第一电离能由大到小排序为 (用元素符号表示);基态e原子的价层电子排布式为 。
(2)配合物e(ac)4在常温下呈液态,易溶于四氯化碳、苯等有机溶剂。固态e(ac)4的晶体类型是 。已知(dab)2分子中含非极性键,分子中每个原子最外层都达到8个电子稳定结构,1mol(dab)2分子含σ键的数目为 。
(3)写出一种与dab-互为等电子体的分子 (填化学式)。ac32-的中心原子杂化类型为 ;dc32-的空间构型为 。
(4)ec晶胞结构如图所示,其晶胞参数为a pm,列式计算该晶胞的密度为 g·cm-3(不必计算出结果,阿伏伽德罗常数的值为NA),晶胞中c粒子的配位数为 。
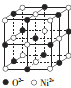
(5)人工合成的ec晶胞存在缺陷,即阳离子有+3、+2价两种。某人工合成的晶体样品组成为e0.96c,则该晶体中+3价、+2价两种离子的个数之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高校曾以下列路线合成药物心舒宁(又名冠心宁),它是一种有机酸盐。
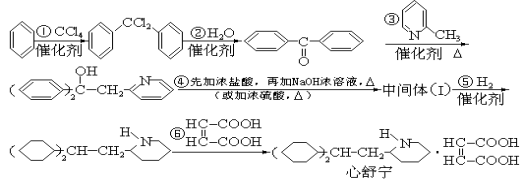
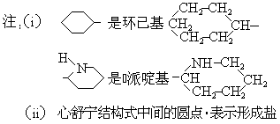
(1)心舒宁的分子式为 。
(2)中间体(Ⅰ)的结构简式是 。
(3)反应①~⑤中属于加成反应的是 (填反应代号).
(4)如果将⑤、⑥两步颠倒,则最后得到的是(写结构简式) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(4)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为_______(已知:N2H4+H+![]() N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为 。
N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com