
| A. | 增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增大 | |
| B. | 向某恒容密闭容器中通入1mol SO2和0.5 molO2,达到平衡时放出热量为98.5 kJ | |
| C. | 升高温度能使逆反应速率加快,正反应速率减慢 | |
| D. | 向某恒容密闭容器中通入一定量的SO2和O2达到平衡后,再通入少量气体He,平衡不移动 |
分析 A、增大反应物浓度,活化分子的百分数不变;
B、2SO2(g)+O2(g)?2SO3(g)是可逆反应不可能完全转化;
C、升高温度正逆反应速率都加快;
D、通入少量气体He,各组分的浓度不变;
解答 解:A、增大反应物浓度,活化分子的数目增多,但是活化分子的百分数不变,故A错误;
B、2SO2(g)+O2(g)?2SO3(g)是可逆反应不可能完全转化,所以达到平衡时放出热量小于98.5 kJ,故B错误;
C、升高温度正逆反应速率都加快,故C错误;
D、通入少量气体He,各组分的浓度不变,平衡不移动,故D正确;
故选D.
点评 本题考查学生化学反应速率的影响因素和平衡移动的原理,题目难度较大,试题培养了学生的分析、理解能力及灵活应用所学知识解决实际问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
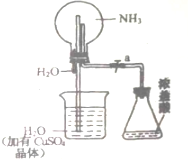 如图,室温下,挤压胶头滴管.待现象发生时,再打开活塞a,烧瓶中能观察到的现象是先形成蓝色喷泉,然后有蓝色沉淀生成后溶解变为蓝色溶液,有关的化学方程式是NH3+H2O=NH3.H2O、CuSO4+2NH3.H2O=Cu(OH)2↓+(NH4)2SO4、Cu(OH)2+2HCl=CuCl2+H2O.
如图,室温下,挤压胶头滴管.待现象发生时,再打开活塞a,烧瓶中能观察到的现象是先形成蓝色喷泉,然后有蓝色沉淀生成后溶解变为蓝色溶液,有关的化学方程式是NH3+H2O=NH3.H2O、CuSO4+2NH3.H2O=Cu(OH)2↓+(NH4)2SO4、Cu(OH)2+2HCl=CuCl2+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (NH4)2SO4浓溶液和CuSO4溶液都能使蛋白质沉淀析出 | |
| B. | 苯中含有碳碳双键,其性质跟乙烯相似 | |
| C. | 乙烯使溴水褪色和苯与溴水混合振荡后水层变为无色原理相同 | |
| D. | 聚乙烯塑料的老化是由于发生了加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
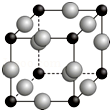 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(用所对应的元素符号表示):查看答案和解析>>
科目:高中化学 来源: 题型:实验题
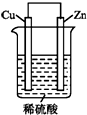 如图是Zn和Cu形成的原电池,回答下列问题:
如图是Zn和Cu形成的原电池,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合溶液的pH=7,则反应后的混合溶液:2c(R2-)+c(HR-)=c(Na+) | |
| B. | 若将CO2通入0.1mol•L-1 Na2CO3溶液中至溶液中性,则溶液中c(H+)-c(CO32-)=c(OH-)-c(H2CO3) | |
| C. | 将c mol•L-1 的醋酸溶液与0.02mol•L-1 NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示醋酸的电离常数Ka=$\frac{2×1{0}^{-9}}{c-0.02}$ | |
| D. | 物质的量浓度之比为1:1的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4使蔗糖炭化变黑,体现了浓H2SO4的氧化性 | |
| B. | 浓H2SO4使蓝色胆矾变成白色,体现了浓H2SO4的脱水性 | |
| C. | 浓H2SO4滴在润湿的蓝色石蕊试纸,试纸先变红,然后褪色,最后变黑,说明浓H2SO4具有酸性、氧化性和脱水性 | |
| D. | 100 mL 18 mol/L的浓H2SO4中加入足量的Cu并加热,被还原的H2SO4的物质的量为0.9 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
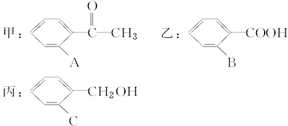 有甲、乙、丙三种有机物,其结构简式如下:
有甲、乙、丙三种有机物,其结构简式如下:| A | B | C |
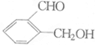 +2Na→2
+2Na→2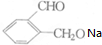 +H2↑.
+H2↑.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com