
| |||||||||||||||||||||||||||||||||||||
科目:高中化学 来源: 题型:
8MnO![]() +5Cu2S+44H+
+5Cu2S+44H+![]() 10Cu2++5SO2+8Mn2++22H2O
10Cu2++5SO2+8Mn2++22H2O
6MnO![]() +5CuS+28H+
+5CuS+28H+![]() 5Cu2++5SO2+6Mn2++14H2O
5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的 KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应。?
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:?
![]()
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为________mol。
(3)欲配制500 mL 0.1 mol·L-1 Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=
(4)混合物中Cu2S的质量分数为________。?
查看答案和解析>>
科目:高中化学 来源: 题型:
8MnO![]() +5Cu2S+44H+====10Cu2++5SO2+8Mn2++22H2O
+5Cu2S+44H+====10Cu2++5SO2+8Mn2++22H2O
6MnO![]() +5CuS+28H+====5Cu2++5SO2+6Mn2++14H2O
+5CuS+28H+====5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,
剩余的KMnO4恰好与350 mL 0.1 mol/L (NH4)2Fe(S04)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
![]() MnO
MnO![]() +
+![]() Fe2++
Fe2++![]() H+==
H+==![]() Mn2++
Mn2++![]() Fe3++
Fe3++![]() H2O
H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为_______mol。
(3)欲配制500 mL 0.1 mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392 g/mol)的质量为______g。
(4)混合物中Cu2S的质量分数为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
8![]() +5Cu2S+44H+====10Cu2++5SO2+8Mn2++22H2O
+5Cu2S+44H+====10Cu2++5SO2+8Mn2++22H2O
6![]() +5CuS+28H+====5Cu2++5SO2+6Mn2++14H2O
+5CuS+28H+====5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1 (NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
___![]() +_____Fe2++______H+====______Mn2++______Fe3++______H2O
+_____Fe2++______H+====______Mn2++______Fe3++______H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为_________ mol。
(3)欲配制500 mL 0.1 mol·L-1 Fe2+溶液,需称取(NH4)2Fe(SO4)2?·6H2O(M=
(4)混合物中Cu2S的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年高三上学期化学《晶体、化学反应中的物质和能量变化》单元测试卷(1) 题型:计算题
(10分)2 g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol·L-1 KMnO4溶液处理,发生反应如下:
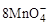 +5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
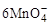 +5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
______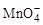 +______Fe2++______H+=______Mn2++______Fe3++______H2O
+______Fe2++______H+=______Mn2++______Fe3++______H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为________mol。
(3)欲配制500 mL 0.1 mol·L-1 Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392 g·mol-1)的质量为________g。
(4)混合物中Cu2S的质量分数为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com