
【题目】下列基态原子的外围价电子排布式中,正确的是( )
A. 3d54s1B. 3d44s2C. 3d94s2D. 3d13p6
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】含苯酚的工业废水的处理流程如图所示。

(1)①流程图设备Ⅰ中进行的是________操作(填写操作名称)。实验室里这一步操作可以用________(填仪器名称)进行。
②在设备Ⅲ中发生反应的化学方程式为________________________。
(2)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是_______________________________________。
(3)为测定废水中苯酚的含量,取此废水100 mL,向其中加入浓溴水至不再产生沉淀为止,得到沉淀0.331 g,此废水中苯酚的含量为______mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、下表是元素周期表的一部分,请回答有关问题:
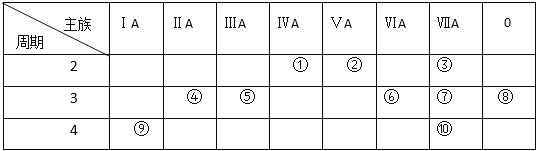
(1)表中能形成两性氢氧化物的元素是 _________ (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式_____________________________。
(2)④元素与⑦元素形成的化合物的电子式 _____________________________。
(3)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 ______。(填化学式)
Ⅱ、A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图为: ,B、C可形成离子化合物B3C2,据此填空:
,B、C可形成离子化合物B3C2,据此填空:
(1)A元素在周期表中的位置_____________________________。
(2)A、B、C、D四种元素的原子,半径由小到大的顺序为_______________。
(3)B和C的最高价氧化物对应的水化物反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10 mL mol·L-1H2A溶液中滴加等浓度的NaOH溶液,混合后溶液的pH与所加NaOH溶液的体积关系如图所示、下列叙述正确的是

A. NaHA的电离方程式为NaHA![]() Na++HA-
Na++HA-
B. B点:c(H2A)+c(H+)=c(OH-)+c(A2-)
C. C点:c(Na+)= c(A2-)+c(HA -)
D. D点:c(Na+)>c(A2-)>c( HA -)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于检测环境中NH3的含量,其工作原理示意图如下。

下列说法不正确的是
A. O2在电极b上发生还原反应
B. 溶液中OH+向电极a移动
C. 负极的电极反应式为:2NH3-6e-+6OH-=N2+6H2O
D. 反应消耗的NH3与O2的物质的量之比为4:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究哈伯法合成氨反应,T℃时,在容积为2 L恒容容器中通入4 mol N2和12mol H2,反应如下: N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.0kJmol-1,相关键能数据如下:
2NH3(g) △H=-92.0kJmol-1,相关键能数据如下:
N≡N | H-H | N-H | |
键能数据( kJ/mol) | 946 | 436 | X |
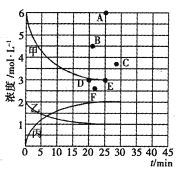
若25min时反应达到平衡,各物质浓度随时间变化曲线如下图中甲、乙、丙。回答下列问题:
(1)0-25min内,反应的平均速率v(H2)为_________;表中X=_________________。
(2)T℃时,该反应的平衡常数K=_____________ (用最简分数表达)。
(3)T℃时,若起始充入8mol N2和24 mol H2,则反应刚达到平衡时,表示c( H2)在右图中相应的点为_____(填字母)。
(4)以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得:
①C(s) +H2O(g)![]() CO(g) +H2(g) △H1
CO(g) +H2(g) △H1
②CO(g) +H2O(g)![]() CO2(g) +H2(g) △H2
CO2(g) +H2(g) △H2
若已知CO和H2的燃烧热分别为283 kJ·mol-l和285.8kJ·mol-l;H2O( g) =H2O(1) △H =-44kJ·mol-l 则△H2=_______________。
(5)氨气是生产硝酸的重要原料,其过程如下:
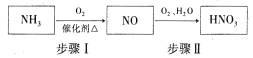
写出步骤I的化学方程式:_________________。
(6)下图是科学家提出的利用电解法常温常压下由氮气、氢气合成氨的示意图:
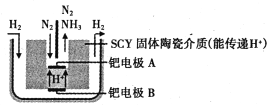
由图可知,钯电极B是电解池的________(填“阴极”或“阳极”);钯电极A上的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产和生活密切相关,下列说法正确的是
A. 乙烯是化学物质,不可用作水果的催熟剂
B. 煤经过气化和液化等物理变化可转化为清洁燃料
C. 石油是混合物,经分馏后得到汽油、煤油和柴油等纯净物
D. 汽油与水互不相溶,但不可以用裂化汽油萃取溴水中的溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若以w1和w2分别表示物质的量浓度为c1 mol/L和c2 mol/L H2SO4溶液的质量分数,且2w1=w2,则下列推断正确的是
A. 2c1=c2 B. 2c2=c1 C. c1<c2<2c1 D. c2>2c1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表达正确的是( )
A. 原子核内有10个中子的氧原子:![]() O
O
B. 氯原子的结构示意图:![]()
C. Fe3+的最外层电子排布式为:3s23p63d5
D. 基态铜原子的外围电子排布图:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com