
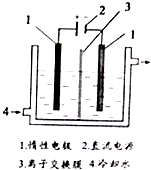
 碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.请回答下列问题:
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.请回答下列问题:分析 (1)碘是紫黑色固体;加热时碘易升华.
(2)KIO3在酸性介质中与过氧化氢作用生成单质碘和氧气;
(3)电解时,阳极上发生氧化反应,碘离子在阳极上失去电子结合氢氧根生成碘酸根离子;
(4)KI溶液在硫酸提供的酸性环境下,被氧气氧化成单质碘,碘单质遇到淀粉变蓝,通常利用此性质检验碘,从而判断反应速率的快慢;
(5)根据KI具有还原性及氧化还原反应、KI3在常温下不稳定性来分析;根据提高加碘盐(添加KI)的稳定性,主要是防止I- 被氧化来分析.
解答 解:(1)碘是紫黑色固体;加热条件下碘易升华,杂质不易升华,所以采用升华的方法分离碘单质,故答案为:紫黑色;升华;
(2)KIO3在酸性介质中与过氧化氢作用生成单质碘和氧气,+5价碘元素降低生成碘单质,-1价的氧升高生成氧气,该反应的离子反应方程式为2IO3-+2H++5H2O2=I2↓+5O2↑+6H2O,故答案为:2IO3-+2H++5H2O2=I2↓+5O2↑+6H2O;
(3)电解时,阳极上发生氧化反应,碘离子向阳极移动,在阳极上失去电子生成碘酸根离子,电极反应式为I-+6OH--6e-=IO3-+3H2O,所以阴极的阴离子氢氧根要移向阳极,所以图中的序号3应为阴离子交换膜,故答案为:阴;I-+6OH--6e-=IO3-+3H2O;
(4)KI溶液在硫酸提供的酸性环境下,被氧气氧化成单质碘,碘单质遇到淀粉变蓝,通常利用此性质检验碘,从而判断反应速率的快慢,所以应先加入淀粉溶液,后加入0.1mol/LH2SO4溶液,反应的离子方程式为:4H++4I-+O2=2I2+2H2O,故答案为:淀粉溶液;0.1mol/LH2SO4溶液;4H++4I-+O2=2I2+2H2O;
(5)KI作为加碘剂的食盐在保存过程中,KI会被空气中氧气氧化,KI在潮湿空气中氧化的反应化学方程式为:4KI+O2+2H2O═2I2+4KOH,根据题目告知,KI3•H2O是在低温条件下,由I2溶于KI溶液可制得.再由题给的信息:“KI+I2?KI3”,可知KI3在常温下不稳定性,低温条件下易分解为KI和I2,KI又易被空气中的氧气氧化,I2易升华,所以KI3•H2O作为食盐加碘剂是不合适的;
提高加碘盐(添加KI)的稳定性,主要是防止I- 被氧化,根据题给信息“还原性:S2O32->I-”和氧化还原反应的强弱规律,可以选Na2S2O3作稳定剂;又由题给信息
“3I2+6OH-═IO3-+5I-+3H2O”,可知I2与OH-会发生反应生成IO3-和5I-,而Na2CO3水解呈碱性,因而也可以用Na2CO3作稳定剂,防止加碘盐(添加KI)在潮湿环境下被氧气氧化.至于AlCl3,水解后呈酸性,且还原性I->Cl-,所不能作稳定剂;NaNO2当遇强还原性物质时能表现出氧化性,则NaNO2与KI能发生氧化还原反应为2NO2-+2I-+4H+=2NO↑+I2+2H2O,所以不能作稳定剂,
故答案为:否;低温制备的KI3受热易分解为I2,而I2受热易升华;AC.
点评 本题考查了碘的物理性质、电解原理、碘离子的检验等性质,难度不大,明确酸性条件下碘离子和碘酸根离子能生成碘单质,碱性条件下,碘能和氢氧根离子生成碘离子和碘酸根离子.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1L庚烷所含有的分子数为$\frac{{N}_{A}}{2.4}$ | |
| B. | 1mol甲基(-CH3)所含电子数为9NA | |
| C. | 标准状况下,B2H6和C2H4的混合气体22.4L,所含的电子数约为16NA | |
| D. | 28g C3H6和C4H8的混合气体中所含C原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铁溶液(硫酸亚铁):通入足量氯气,充分反应后加热,使多余氯气逸出 | |
| B. | 苯(苯酚):加入足量的浓溴水,充分振荡,静置分层后分离 | |
| C. | CO2(SO2):通入盛有Na2CO3溶液的洗气瓶 | |
| D. | Mg(OH)2:放入水中调成浆状,加入足量MgCl2溶液,充分搅拌,过滤,沉淀用蒸馏水洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醛基的结构简式-COH | B. | 丙烯分子的结构简式为:CH3CHCH2 | ||
| C. | 四氯化碳分子的电子式为: | D. | 2-乙基-1,3-丁二烯的键线式: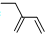 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | A2+与D2-的核外电子数相等 | |
| B. | B与E形成的化合物既能与强酸反应又能与强碱反应 | |
| C. | 原子的失电子能力:C>A | |
| D. | 单质与浓度相等的稀盐酸反应的速率为B>A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加N2的浓度能加快反应速率 | |
| B. | 降低体系温度能加快反应速率 | |
| C. | 使用催化剂不影响反应速率 | |
| D. | 若反应在密闭容器中进行,N2和H2能100%转化为NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com