
 ”表示在空气中形成酸雨的两条途径:
”表示在空气中形成酸雨的两条途径:科目:高中化学 来源: 题型:阅读理解


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2010年云南省部分名校高三5月联考试题理科综合化学 题型:填空题
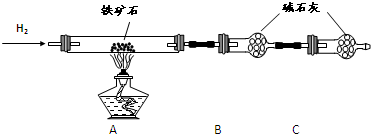
(18分)铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定
① 按上图组装仪器,检查装置的气密性;
② 将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
③从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯;
④ 充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为 。
(2)测的反应后装置B增重1.35g,则铁矿石中氧的百分含量为 。
(3)若将H2换成CO,则还需补充 装置。
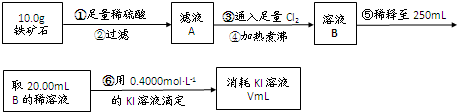
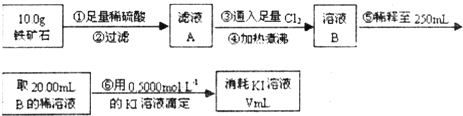
Ⅱ.铁矿石中含铁量的测定
(1)溶液A中铁元素可能的存在形式 ;请从以下试剂中选择最佳试剂用最简单的实验验证A中铁元素的存在形式,试剂为: 。
a.酸性KMnO4溶液 b.NaOH溶液 c.KSCN溶液 d.氯水
(2)步骤④中煮沸的作用是 。
(3)步骤⑤中用到的玻璃仪器有: 。
(4)下列有关步骤⑥的操作中说法正确的是 。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测夜润洗
e.滴定时,右手控制滴定管,左手摇动锥形瓶
f.滴定过程中,眼睛注视滴定管中液面变化
g.滴定结束后,待液面稳定后再读数
(5)若滴定过程中消耗0.5000mol·L?1的KI溶液20.00mL,则铁矿石中铁的百分含量为 。
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为 。
查看答案和解析>>
科目:高中化学 来源:2015届福建省高一下学期期中考试化学试卷(解析版) 题型:实验题
铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某不同品牌铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
[探究一] 实验方案:铝镁合金 测定生成气体的体积
测定生成气体的体积
实验装置如下图,问题讨论:

(1)反应完毕,每间隔1分钟读取气体体积,气体体积逐渐减小,直至不变。气体体积减小的原因是
(仪器和实验操作的影响因素除外)。
(2)为使测定结果尽可能精确,实验中应注意的问题除了检查装置的气密性、加入足量盐酸使合金完全溶解和按(1)操作外,请再写出两点:
①
②
(3)如果用分析天平准确称取0.51g镁铝合进行实验,测得生成气体体积为560 mL(已折算成标况下体积),请计算合金中镁的质量分数。(请写出计算过程)___________ ____________________________________________________________________________。
[探究二] 实验方案:称量Bg另一品牌铝镁合金粉末.放在如下图所示装置的惰性电热板上,通电使其充分灼烧。
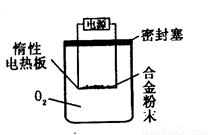
问题讨论:
(1)欲计算Mg的质量分数,该实验中还需测定的数据是 。
(2)用本方案进行实验时,装置中至少要充入O2的物质的量 mol(用含B的最简式表示)。
[实验拓展] 研究小组对某无色透明的溶液进行实验,发现该溶液跟铝反应时放出H2,试判断下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、HCO3-、OH-、NO3-,在下列两种情况下,可能存在于此溶液中的是:
①当与铝反应后生成Al3+时,原溶液可能大量存在的离子 。
②当与铝反应后生成[Al(OH)4]-时,原溶液可能大量存在的离子是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com