
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | ⑩ |
| ||
| △ |
| ||
| △ |


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
| A、苹果是酸性食物 |
| B、猪肉、牛肉是碱性食物 |
| C、大米、面包是碱性食物 |
| D、巧克力、奶油是酸性食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 元素A的单质及元素A与元素B形成的化合物有如图所示的转化关系:
元素A的单质及元素A与元素B形成的化合物有如图所示的转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:
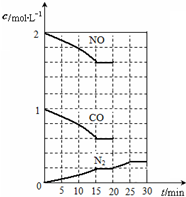 降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com