
分析 设Na和K,分别为xmol和ymol,则23x+39y=88.5①,又知2Na~H2,2K~H2,故生成H2的物质的量为$\frac{1}{2}$(x+y),并根据H2+CuO=Cu+H2O~△m=16g,中氢气的量得出另外一个关系式16(x+y)=24②,据此进行分析.
解答 解:设Na和K,分别为xmol和ymol,则23x+39y=88.5①,又知2Na~H2,2K~H2,故生成H2的物质的量为$\frac{1}{2}$(x+y),
H2+CuO=Cu+H2O△m
1 16
$\frac{1}{2}$(x+y) 24
则:16×$\frac{1}{2}$(x+y)=24②,联立①②解得x=$\frac{57}{32}$mol,y=$\frac{39}{32}$mol,
则x:y=19:13.
答:钠和钾的物质的量之比为19:13.
点评 本题比较简单,正确书写化学方程式是本题解题的关键,固体减少的质量即为氧元素的质量.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向硝酸银溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| B | 向某溶液中滴加CCl4,振荡静置 | 下层溶液显紫色 | 原溶液中含有I- |
| C | 向25mL沸水中分别滴入5~6滴FeCl3饱和溶液,继续煮沸至出现红褐色沉淀,用激光笔照射 | 形成一条光亮通路 | 制得Fe(OH)3胶体 |
| D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液颜色变浅 | Na2CO3溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2,3,3 四甲基丁烷 | B. | 2,3,4 三甲基戊烷 | ||
| C. | 3,3,4,4 四甲基己烷 | D. | 2,5 二甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢铵溶液与足量氢氧化钠溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | 将少量氯化铁溶液滴入硫化钠溶液中:2Fe3++S2-═2Fe2++S↓ | |
| C. | 向Fe(NO3) 2稀溶液中加入盐酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ | |
| D. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
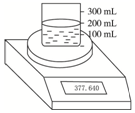 如图所示测定Na2O2(含Na2O杂质)纯度的实验装置,不同时间电子天平的读数如列表所示:
如图所示测定Na2O2(含Na2O杂质)纯度的实验装置,不同时间电子天平的读数如列表所示:| 实验操作 | 时间/s | 电子天平读数/g |
| 烧杯+水 | 370.000 | |
| 烧杯+水+样品 | 0 | 377.640 |
| 30 | 376.920 | |
| 60 | 376.400 | |
| 90 | 376.200 | |
| 120 | 376.200 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
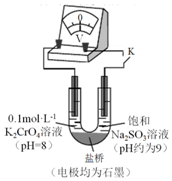 为探究Na2SO3溶液和铬(VI)盐溶液的反应规律,某同学进行实验如下:
为探究Na2SO3溶液和铬(VI)盐溶液的反应规律,某同学进行实验如下:| 序号 | 操作 | 现象 |
| i | 向2mL pH=2的0.05mol•L-1 K2Cr2O7橙色溶液中滴加饱和Na2SO3溶液(pH 约为 9)3滴 | 溶液变绿色(含Cr3+) |
| ii | 向2mL pH=8的0.1mol•L-1 K2CrO4黄色溶液中 滴加饱和Na2SO3溶液3滴 | 溶液没有明显变化 |
| 序号 | 操作 | 现象 |
| iii | 向2mL饱和Na2SO3溶液中滴加pH=2的0.05mol•L-1 K2Cr2O7橙色溶液3滴 | 溶液变黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 关于有机物A的说法不正确的是( )
关于有机物A的说法不正确的是( )| A. | A的分子式为C16H1403 | |
| B. | A可使酸性KMnO4溶液褪色和溴水褪色 | |
| C. | A苯环上的一氯代物同分异构体有2种 | |
| D. | A既可发生氧化反应和加成反应,又可以发生取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com