
| A. | 6 g碳完全燃烧时放出热量196.8 kJ | |
| B. | CO的燃烧热△H=-283.0 kJ/mol | |
| C. | H2的燃烧热△H=-241.8 kJ/mol | |
| D. | 制备水煤气的反应热△H=+131.3 kJ/mol |
分析 A、反应①中,1mol碳完全燃烧生成二氧化碳放热393.5KJ;
B、燃烧热是在101KP下,1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,根据盖斯定律来分析;
C、燃烧热是在101KP下,1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,生成的水为液态;
D、制备水煤气的反应为:C+H2O=CO+H2,根据盖斯定律来分析.
解答 解:A、反应①中,1mol碳完全燃烧生成二氧化碳放热393.5KJ,故6g碳即0.5mol碳完全燃烧放出196.8KJ热量,故A正确;
B、燃烧热是在101KP下,1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,根据盖斯定律,将①-$\frac{②}{2}$可得:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=(-393.5kJ/mol)-($\frac{-221KJ/mol}{2}$)=-283KJ/mol,故CO的燃烧热△H=-283.0 kJ/mol,故B正确;
C、燃烧热是在101KP下,1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,生成的水应为液态,但反应③中生成的水为水蒸气,故不能根据此反应来得出氢气的燃烧热,故C错误;
D、制备水煤气的反应为:C+H2O=CO+H2,根据盖斯定律可知:将$\frac{②-③}{2}$可得:C(s)+H2O(g)=CO(g)+H2(g)△H=$\frac{483.6KJ-221KJ}{2}$=+131.3 kJ/mol,故D正确.
故选C.
点评 本题考查了盖斯定律的应用和燃烧热的概念,难度不大,应注意的是燃烧热的概念中生成的一定是稳定的氧化物.


科目:高中化学 来源: 题型:选择题
| A. | 某溶液的pH=7,则该溶液为中性溶液 | |
| B. | 一定温度下,向AgCl饱和溶液中加入少量NaCl固体,Ksp(AgCl)减小 | |
| C. | 常温下,反应X(s)+Y(l)═2Z(g)不能自发,则该反应的△H>0 | |
| D. | 常温下,0.01mol/L的NaOH溶液中由水电离的c(H+)=1.0×10-2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
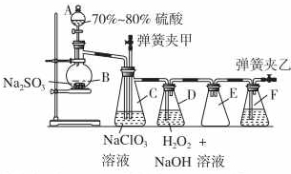 装置C中发生反应:2NaClO3+SO2═2ClO2+Na2SO4 (Ⅰ)
装置C中发生反应:2NaClO3+SO2═2ClO2+Na2SO4 (Ⅰ)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K与F | B. | Na与F | C. | Al与Cl | D. | Mg与Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液和Al2(SO4)3溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 | |
| B. | 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度 | |
| C. | TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+4HCl 工业上利用该反应制备TiO2纳米粉 | |
| D. | 泡沫灭火器中常使用的原料是碳酸钠和硫酸铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能够发生有效碰撞的分子叫做活化分子,活化分子所多出的那部分能量称作活化能 | |
| B. | 对于某一反应aA+bB=cC+dD,△H单位中的mol-1是指每摩尔(aA+bB=cC+dD)反应 | |
| C. | 研究有机物的组成、结构、性质、制备方法与应用的科学叫有机化学 | |
| D. | 甲烷分子具有正四面体结构的原因是碳原子的2S轨道与2P轨道发生SP杂化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com