
 已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族. E、F都是第四周期元素,E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空:
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族. E、F都是第四周期元素,E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空: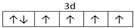 ,F原子的电子排布式是1s22s22p63s23p63d104s1.
,F原子的电子排布式是1s22s22p63s23p63d104s1. .
.分析 A、B、C、D四种短周期元素,它们的核电荷数依次增大,A与C原子的基态电子排布中L能层都有两个未成对电子,且A原子序数需要C,则A是C、C是O元素,B元素原子序数介于A和C之间,则B是N元素;C、D同主族,则D是S元素;
E、F都是第四周期元素,F原子除最外能层只有1个电子外,其余各能层均为全充满,则F是Cu元素;E原子的基态电子排布中有4个未成对电子,则E是Fe元素;
(1)D是S元素,S原子核外有K、L、M三个电子层,基态S原子中,电子占据的最高能层符号M,该能层有1个s轨道、3个p轨道、5个d轨道;
(2)E是Fe元素,Fe原子失去最外层2个电子生成Fe2+,其3d电子为其价电子,根据构造原理书写Cu原子的电子排布式;
(3)根据价层电子对互斥理论判断原子杂化方式和分子VSEPR模型;
(4)等电子体结构和性质相似,根据二氧化碳结构书写该离子电子式;
(5)配合物甲的焰色反应呈紫色,含有K元素,其内界由中心离子Fe3+与配位体CN-构成,配位数为6,甲为K3[Fe(CN)6],甲的水溶液可以用于实验室中Fe2+离子的定性检验;
(6)根据均摊分确定该晶胞化学式;其密度=$\frac{m}{V}$.
解答 解:A、B、C、D四种短周期元素,它们的核电荷数依次增大,A与C原子的基态电子排布中L能层都有两个未成对电子,且A原子序数需要C,则A是C、C是O元素,B元素原子序数介于A和C之间,则B是N元素;C、D同主族,则D是S元素;
E、F都是第四周期元素,F原子除最外能层只有1个电子外,其余各能层均为全充满,则F是Cu元素;E原子的基态电子排布中有4个未成对电子,则E是Fe元素;
(1)基态S原子中电子占据的最高能层为第3能层,符号M,该能层有1个s轨道、3个p轨道、5个d轨道,共有9 个原子轨道,故答案为:M;9;
(2)Fe2+离子的价层电子排布3d6,其价层电子排布图是 ,F为Cu元素,原子核外有29个电子,原子的电子排布式是1s22s22p63s23p63d104s1,
,F为Cu元素,原子核外有29个电子,原子的电子排布式是1s22s22p63s23p63d104s1,
故答案为: ;1s22s22p63s23p63d104s1;
;1s22s22p63s23p63d104s1;
(3)碳元素的最高价氧化物对应的水化物为H2CO3,分子结构式为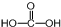 ,中心C原子成3个σ键、没有孤电子对,C原子采取sp2杂化方式;B的气态氢化物为NH3,N原子价层电子对个数是4且含有一个孤电子对,所以其VSEPR模型为四面体形,故答案为:sp2;四面体形;
,中心C原子成3个σ键、没有孤电子对,C原子采取sp2杂化方式;B的气态氢化物为NH3,N原子价层电子对个数是4且含有一个孤电子对,所以其VSEPR模型为四面体形,故答案为:sp2;四面体形;
(4)化合物CO2、N2O和阴离子SCN-互为等电子体,它们结构相似,SCN-中C原子与S、N原子之间形成2对共用电子对,SCN-的电子式为 ,
,
故答案为: ;
;
(5)配合物甲的焰色反应呈紫色,含有K元素,其内界由中心离子Fe3+与配位体CN-构成,配位数为6,甲为K3[Fe(CN)6],甲的水溶液可以用于实验室中Fe2+离子的定性检验,检验Fe2+离子的离子方程式为:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,
故答案为:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓;
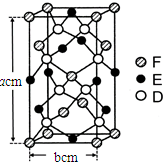
(6)晶胞中D(S)原子位于晶胞内部,原子数目为8个,E(Fe)原子6个位于面上、4个位于棱上,E(Fe)原子数目=6×$\frac{1}{2}$+4×$\frac{1}{4}$=4,F(Cu)原子位于4个位于面上、1个内部、8个顶点上,原子数目=4×$\frac{1}{2}$+1+8×$\frac{1}{8}$=4,晶体中Cu、Fe、S原子数目之比=4:4:8=1:1:2,故该晶体化学式为:CuFeS2,
晶胞质量=$\frac{(56+64+32×2)g/mol}{6.02×1{0}^{23}/mol}$×4,晶胞体积=(bcm)2×acm=ab2cm3,
该晶体的密度d=($\frac{(56+64+32×2)g/mol}{6.02×1{0}^{23}/mol}$×4)÷ab2cm3=$\frac{\frac{164}{6.02×1{0}^{23}}×4}{a{b}^{2}}$g/cm3,
故答案为:CuFeS2;$\frac{\frac{164}{6.02×1{0}^{23}}×4}{a{b}^{2}}$.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、离子方程式书写、电子式书写、核外电子排布式书写等知识点,侧重考查学生分析计算及空间想象能力,明确构造原理、价层电子对互斥理论、均摊分等基本理论是解本题关键,难点是晶胞计算.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 质子数是2 | B. | 电子数是2 | C. | 质量数是3 | D. | 中子数是1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素单质是导体 | |
| B. | 该元素单质在一定条件下能与盐酸反应 | |
| C. | 该元素的氧化物的水合物显碱性 | |
| D. | 该元素的最高价氧化物对应的水化物为两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
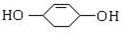 ;
;
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )也叫3,4-二羟基桂皮酸,它存在于许多种药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,对内脏的止血效果较好,毒性较小,还有镇咳、祛痰等疗效.
)也叫3,4-二羟基桂皮酸,它存在于许多种药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,对内脏的止血效果较好,毒性较小,还有镇咳、祛痰等疗效. .写出咖啡酸与NaHCO3溶液反应的方程式::
.写出咖啡酸与NaHCO3溶液反应的方程式:: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO的燃烧热为-283 kJ/mol | |
| B. | 在③反应时,若加入催化剂,可以使△H减小 | |
| C. | 若投入1molCO2和3molH2在一定条件下充分反应,则放出热量49 kJ | |
| D. | 若生成相同质量的CO2,则放出的热量C2H2大于CO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ③⑤ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
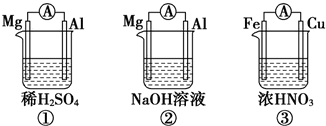
| A. | ①②中Mg作负极,③中Fe作负极 | |
| B. | ②中Al作正极,其电极反应式为Al-3e-=Al3+ | |
| C. | ③中Fe作负极,电极反应式为Fe-2e-=Fe2+ | |
| D. | 若①②中转移的电子数相同,则①②中产生的H2的量也一定相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com