
【题目】下列溶液一定呈中性的是![]()
A.![]() 的溶液B.
的溶液B.![]() 的溶液
的溶液
C.![]() 的溶液D.使石蕊溶液呈紫色的溶液
的溶液D.使石蕊溶液呈紫色的溶液
【答案】A
【解析】
溶液的酸碱性是根据溶液中![]() 浓度与
浓度与![]() 浓度的相对大小判断,当
浓度的相对大小判断,当![]() ,溶液就呈酸性;当
,溶液就呈酸性;当![]() ,溶液就呈中性;当溶液中
,溶液就呈中性;当溶液中![]() ,溶液就呈碱性;注意不能根据溶液的pH值大小判断。
,溶液就呈碱性;注意不能根据溶液的pH值大小判断。
A、氢离子浓度和氢氧根离子浓度的相对大小是判断溶液的酸碱性的依据,所以![]() 的溶液一定呈中性,故A正确;
的溶液一定呈中性,故A正确;
B、常温下,水的离子积![]() ,所以,
,所以,![]() ,溶液呈酸性;
,溶液呈酸性;![]() ,溶液呈中性;
,溶液呈中性;![]() ,溶液呈碱性。
,溶液呈碱性。![]() 受温度影响,水的电离是吸热的,温度越高
受温度影响,水的电离是吸热的,温度越高![]() 越大,如
越大,如![]() 时,水的离子积常数是
时,水的离子积常数是![]() ,当
,当![]() 时溶液呈中性,当
时溶液呈中性,当![]() 时溶液呈碱性,该选项中
时溶液呈碱性,该选项中![]() 的溶液,不一定是在常温下,溶液中
的溶液,不一定是在常温下,溶液中![]() 、
、![]() 不一定相等,故B错误;
不一定相等,故B错误;
C、![]() 的溶液,不能判断溶液中氢离子与氢氧根离子的浓度大小,无法判断溶液的酸碱性,故C错误;
的溶液,不能判断溶液中氢离子与氢氧根离子的浓度大小,无法判断溶液的酸碱性,故C错误;
D、石蕊的变色范围是5~8,使石蕊试液呈紫色的溶液,常温下溶液可能显酸性,也可能显中性或碱性,故D错误;
故选:A。


科目:高中化学 来源: 题型:
【题目】恒温、恒压下,1molA和nmolB在一个容积可变的密闭容器中发生如下反应:A(g)+2B(g)![]() 2C(g),一段时间后达到平衡,生成amolC,则下列说法中正确的是()
2C(g),一段时间后达到平衡,生成amolC,则下列说法中正确的是()
A. 当n=2时,物质A、B的转化率之比为1: 2
B. 起始时刻和达到平衡后容器中的压强比为(1+n):(l+n-a/2)
C. 当v (A)正=2v (C)逆时,可断定反应达到平衡
D. 容器中混合气体的密度不再随时间改变而改变,反应到达平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖。轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是
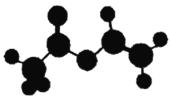
A.该化合物的名称为乙酸乙酯
B.该化合物与![]() 的四氯化碳溶液不反应
的四氯化碳溶液不反应
C.该化合物既能发生水解反应,又能发生缩聚反应
D.该化合物的链状同分异构体中,能与![]() 反应放出
反应放出![]() 的只有3种
的只有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在298K、100 kPa时,已知:①2H2O(g)![]() O2(g)+2H2(g) △H1 K1
O2(g)+2H2(g) △H1 K1
②Cl2(g)+H2(g) ![]() 2HCl(g) △H2 K2
2HCl(g) △H2 K2
③2Cl2(g)+2H2O(g![]() 4HCl(g)+O2(g) △H3 K3
4HCl(g)+O2(g) △H3 K3
则△H1、△H2、△H3间的关系是_________,K1、K2、K3间的关系是___________。
II.高温下,炼铁高炉中存在下列平衡:FeO(s)+CO(g)![]() Fe(s)+CO2(g) △H>0。试回答下列问题:
Fe(s)+CO2(g) △H>0。试回答下列问题:
(1)写出该反应的平衡常数表达式________。
(2)升高温度,该反应的平衡常数K值将________(填“增大”、“减小”、“不变”),平衡体系中固体的质量将________填“增大”、“减小”、“不变”)。
(3)已知1100℃时该反应的平衡常数K=0.263。在该温度测得高炉中c(CO2)=0.025 mol·L-1,c(CO)=0.1 mol·L-1,此时该化学反应的速度是v(正)______ v(逆)(填”>”、“<”、“=”),原因是________。
(4)保持高炉温度为1100 ℃,向高炉中补充大量的空气,重新达到平衡后,该反应的平衡常数K值________0.263(填”>”、“<”、“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可分别通过如下两个反应制取氢气: ( )
a.CH3CH2OH(g)+H2O(g) ![]() 4H2(g)+2CO(g) ΔH=+256.6 kJ·mol-1
4H2(g)+2CO(g) ΔH=+256.6 kJ·mol-1
b.2CH3CH2OH(g)+O2(g) ![]() 6H2(g)+4CO(g) ΔH=+27.6 kJ·mol-1
6H2(g)+4CO(g) ΔH=+27.6 kJ·mol-1
则下列说法正确的是( )
A.乙醇的燃烧热ΔH=-13.8 kJ·mol-1
B.升高反应a的反应温度,乙醇的转化率减小
C.2H2(g)+O2(g)=2H2O(g) ΔH=-229 kJ·mol-1
D.制取等量的氢气,反应b吸收的能量更少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25°C时,c(CH3COOH)+ c(CH3COO-)=0.1mol/L的醋酸、醋酸钠混合溶液中,c(CH3COOH)、 c(CH3COO-)与pH的关系如图所示。下列有关该溶液的叙述不正确的是
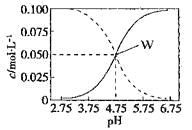
A.pH=4的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.W点所表示的溶液中:c(Na+)+ c(H+)= c(CH3COOH)+c(OH-)
C.将W点所表示的1.0L溶液稀释到10L,用pH计测量,溶液的pH应为5.75
D.pH=5.5的溶液中:c(Na+)+ c(H+)- c(OH-)+c(CH3COOH)=0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1 L的容器中,通入一定量的N2O4,发生反应N2O4(g) ![]() 2NO2(g),若升高体系温度,则混合气体的颜色将变深。实验测得,保持体系温度为100 ℃,体系中各物质的浓度随时间的变化如图所示;90 s后,将体系温度改为T ℃,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s重新达到平衡。
2NO2(g),若升高体系温度,则混合气体的颜色将变深。实验测得,保持体系温度为100 ℃,体系中各物质的浓度随时间的变化如图所示;90 s后,将体系温度改为T ℃,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s重新达到平衡。
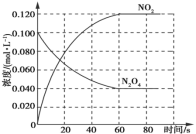
下列说法错误的是( )
A.0~60 s时段内,平均反应速率v(NO2)=0.002 0 mol·L-1·s-1
B.60 s后,体系温度保持100 ℃,则混合气体的平均相对分子质量保持不变
C.T ℃>100 ℃,第100 s时,c(N2O4)=0.020 mol·L-1
D.100 s后,在T ℃将容器体积缩小为0.5 L,则正反应速率减小,逆反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图。下列说法不正确的是( )

A. 25 ℃时,在0~30 min内,R的分解平均速度为0.033 mol·L-1·min-1
B. 对比30 ℃和10 ℃曲线,在50 min时,R的分解百分率相等
C. 对比30 ℃和25 ℃曲线,在0~50 min内,能说明R的分解平均速度随温度升高而增大
D. 对比30 ℃和10 ℃曲线,在同一时刻,能说明R的分解速率随温度升高而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
(1)实验一:取等物质的量浓度等体积H2O2溶液分别进行下列实验,实验报告如下表所示。
序号 | 条件 | 现象 | 结论 | |
温度/℃ | 催化剂 | |||
1 | 40 | FeCl3溶液 | ||
2 | 20 | FeCl3溶液 | ||
3 | 20 | MnO2 | ||
4 | 20 | 无 | ||
试回答:
①实验1、2研究的是_______________对H2O2分解速率的影响。
②实验2、3的目的是_____________________________________________________。
(2)实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显但不久突然褪色,反应速率明显加快。
①针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是_____________________的影响。
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是___________。
A、硫酸钾B、硫酸锰C、水D、氯化锰
(3)实验三:经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
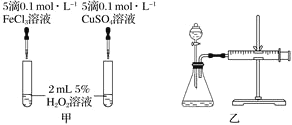
①定性如图甲可通过观察________________________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是______________________________。
②定量如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com