
【题目】某氯化铁(FeCl3)样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行,根据流程回答以下问题:
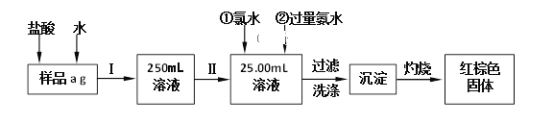
(1)操作I是配制溶液,所用到的玻璃仪器除烧杯、玻璃棒外,还必须有_______、_______。
(2)写出加入氯水发生的离子反应方程式________________________________。
(3)写出加入过量氨水发生的离子反应方程式_______________________________。
(4)写出灼烧发生反应的化学方程式_______________________________。
(5)检验沉淀是否已经洗涤干净的操作是______________________________。
(6)下列操作可能使所配溶液浓度偏小的是__________(填写序号)。
①未洗涤烧杯和玻璃棒
②定容时俯视容量瓶的刻度线
③配溶液前容量瓶中有少量蒸馏水
④摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
(7)若原样品质量a为10g,加热后红棕色固体质量是0.6g,则样品中铁元素的质量分数是_____________。
【答案】250mL容量瓶 胶头滴管。 2Fe2++Cl2==2Fe3++2Cl— Fe3++3NH3H2O= Fe(OH)3↓+3NH4+ 2Fe(OH)3![]() Fe2O3+3H2O 取最后一次洗涤液少许,加入硝酸酸化的硝酸银溶液,若产生白色沉淀则没有洗涤干净;若没有产生白色沉淀则洗涤干净。 ①④ 42%
Fe2O3+3H2O 取最后一次洗涤液少许,加入硝酸酸化的硝酸银溶液,若产生白色沉淀则没有洗涤干净;若没有产生白色沉淀则洗涤干净。 ①④ 42%
【解析】
本实验目的是测定铁的质量分数,采取的方法是使样品溶解、反应、最终生成氧化铁,然后通过氧化铁质量来求铁的质量分数;
(1) 根据配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶;
(2) 根据Cl2具有氧化性,能氧化Fe2+;
(3)加入过量氨水的目的是将溶液中的Fe3+完全转化为Fe(OH)3沉淀;
(4) Fe(OH)3受热分解生成Fe2O3和水;
(5) 取最后一次洗涤液少许,加入硝酸酸化的硝酸银溶液,若产生白色沉淀则没有洗涤干净;若没有产生白色沉淀则洗涤干净;
(6) 依据溶液配制过程和实验步骤分析判断选项中,根据c=![]() =
=![]() 来分析各操作对浓度的影响;
来分析各操作对浓度的影响;
(7) 加热分解所得的物质是Fe2O3,其质量为0.6g,由于取的25mL溶液,故250mL溶液可以得到Fe2O3质量为6g,根据化学式计算铁元素的质量,再利用质量分数的定义计算原氧化铁样品中铁元素的质量分数。
实验目的为测定铁的质量分数,采取的方法是使样品溶解、反应、最终生成氧化铁,然后通过氧化铁质量来求铁的质量分数;
(1)因配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶,配制250mL溶液时还缺少250mL容量瓶和胶头滴管;
(2)因Cl2具有氧化性,能氧化Fe2+,发生反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-;
(3)加入过量氨水的目的是将溶液中的Fe3+完全转化为Fe(OH)3沉淀,发生的离子反应方程式Fe3++3NH3H2O= Fe(OH)3↓+3NH4+;
(4)灼烧是Fe(OH)3分解生成Fe2O3和水,发生反应的化学方程式为2Fe(OH)3![]() Fe2O3+3H2O;
Fe2O3+3H2O;
(5) 最后一次洗出液,滴加AgNO3溶液,若无沉淀生成,可证明洗涤干净,
(6) 依据溶液配制过程和实验步骤分析判断选项,根据c=![]() =
=![]() 来
来
①未洗涤烧杯和玻璃棒,溶质未全部转移到容量瓶,使得m减少,浓度偏低,故①正确;
②定容时俯视容量瓶的刻度线,容量瓶中水未加到刻度线,使得V偏小,浓度偏大,故②错误;
③配溶液前容量瓶中有少量蒸馏水对配制溶液浓度无影响,故③错误;
④摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切,使得V偏大,溶液浓度偏小,故④正确;
故答案为:①④;
(7) 加热分解所得的物质是Fe2O3,其质量为0.6g,由于取的25mL溶液,故250mL溶液可以得到Fe2O3质量为6g,依据铁元素守恒计算铁元素的质量分数= 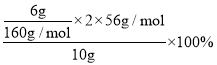 =42%。
=42%。


科目:高中化学 来源: 题型:
【题目】向密闭容器中充入物质A和B,发生反应aA(g)+bB(g)![]() cC(g)。反应过程中,物质A的体积分数和C的体积分数随温度(T)的变化曲线如图所示,下列说法正确的是( )
cC(g)。反应过程中,物质A的体积分数和C的体积分数随温度(T)的变化曲线如图所示,下列说法正确的是( )
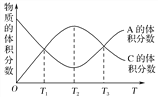
A. 该反应在T1、T3温度时达到化学平衡
B. 该反应在T2温度时达到化学平衡
C. 该反应的逆反应是放热反应
D. 升高温度,平衡会向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到目的的是( )
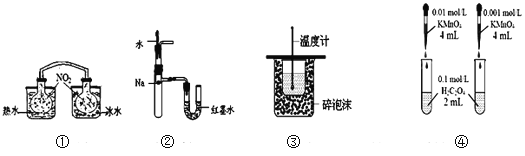
A. 装置①依据两容器内气体颜色变化,不能判断反应2NO2(g)![]() N2O4(g)平衡移动的方向
N2O4(g)平衡移动的方向
B. 装置②依据U管两边液面的高低判断Na和水反应的热效应
C. 装置③测定中和热
D. 装置④依据褪色快慢比较浓度对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学们按照下面的实验方法制备氢氧化铁胶体:首先取少量蒸馏水于洁净的烧杯中,用酒精灯加热至沸腾,向烧杯中逐滴滴加饱和的FeCl3溶液继续煮沸,至液体呈透明的红褐色。
(1)发生反应的化学方程式为______,判断胶体制备是否成功,可利用胶体的____________ 。
(2)在做制备氢氧化铁胶体的实验时,有些同学没有按要求进行,结果没有观察到胶体,请你预测其现象并分析原因:
①甲同学没有选用饱和氯化铁溶液,而是将稀氯化铁溶液滴入沸水中,结果没有观察到_____,其原因是______________
②乙同学在实验中没有使用蒸馏水,而是用自来水,结果会__________,原因是___________
③丙同学向沸水中滴加饱和氯化铁溶液后,长时间加热,结果会_________,原因是________
(3)丁同学按要求制备了Fe(OH)3胶体,但是他又向Fe(OH)3胶体中逐滴加入了稀H2SO4溶液,结果出现了一系列变化。
①先出现红褐色沉淀,原因是_______________________________________
②随后沉淀溶解,此反应的离子方程式是___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意图如下:
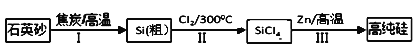
(1)1mol焦炭在过程Ⅰ中失去____mol电子。
(2)过程Ⅱ中Cl2用电解饱和食盐水制备,制备Cl2的离子方程式为________。
(3)步骤(2)中的电解过程中,若用甲醇燃料电池作电源,用KOH作电解质,负极反应为_________。
(4)整过生产过程必须严格控制无水,回答下列问题:
①SiCl4遇水剧烈水解生成SiO2和一种酸,化学反应方程式为_________。
②干燥Cl2时从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中。冷却的作用是_________。
(5)Zn还原SiCl4的可逆反应如下:
SiCl4(g)+2Zn(s)![]() Si(S)+2ZnCl2(g)△H<0下列说法正确的是(___)
Si(S)+2ZnCl2(g)△H<0下列说法正确的是(___)
A.还原过程需在无氧的气氛中进行 |
B.投入1molZn可生成14g还原产物 |
C.增加SiCl4(g)的量,该反应平衡常数不变 |
D.若SiCl4(g)过量可增大△H的值 |
(6)有一种由硅制作的材料中常加入Ag2SO4 ,已知某温度下Ag2SO4(M=312g/mol)的溶解度为0.624g/100g H2O,该温度下Ag2SO4的Ksp=_______(两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(除H2O外,含有CCl4、I2、I等)中回收碘,其实验过程如下:
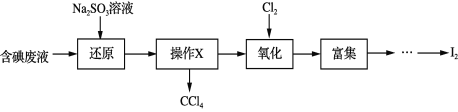
下列叙述不正确的是
A. “操作X”的名称为萃取,可在分液漏斗中进行
B. “还原”步骤发生的反应为:SO32+I2+H2O == 2I+SO42+2H+
C. “氧化”过程中,可用双氧水替代氯气
D. “富集”即I2富集于有机溶剂,同时除去某些杂质离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】少量铁粉与![]() 的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变
的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变![]() 的产量,可以使用如下方法中的( )
的产量,可以使用如下方法中的( )
①加![]() ②加
②加![]() 固体 ③滴入几滴浓盐酸
固体 ③滴入几滴浓盐酸
④改用![]() 的硝酸 ⑤加
的硝酸 ⑤加![]() 溶液 ⑥滴加几滴硫酸铜溶液
溶液 ⑥滴加几滴硫酸铜溶液
⑦升高温度(不考虑盐酸挥发) ⑧改用![]() 的盐酸
的盐酸
A. ③⑤⑥⑦B. ③⑦⑧C. ③⑥⑦⑧D. ③④⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一铁的氧化物样品,用140 mL 5 mol·L-1的盐酸恰好完全溶解,所得溶液还能与通入的0.56 L氯气(标准状况)反应,使Fe2+全部转化为Fe3+,则此氧化物为
A.Fe2O3B.Fe3O4C.Fe4O5D.Fe5O7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com