
分析 在①pH=3的硫酸溶液和②pH=3的醋酸溶液中氢离子浓度相同,硫酸溶液中完全电离,醋酸溶液中存在电离平衡,平衡状态下氢离子浓度等于硫酸溶液中氢离子浓度为0.001mol/L,醋酸溶液浓度大于硫酸溶液浓度,加水稀释相同倍数,促进醋酸电离平衡正向进行,据此分析回答.
解答 解:在①pH=3的硫酸溶液和②pH=3的醋酸溶液中氢离子浓度相同,投入足量锌粉,开始时反应速率大小相同,①=②,硫酸溶液中完全电离,醋酸溶液中存在电离平衡,平衡状态下氢离子浓度等于硫酸溶液中氢离子浓度为0.001mol/L,醋酸溶液浓度大于硫酸溶液浓度,和足量锌粉反应生成氢气的体积在同温同压下,醋酸生成氢气多,生成的H2的体积①<②,在①pH=3的硫酸溶液和②pH=3的醋酸溶液中加水稀释相同倍数,促进醋酸电离平衡正向进行,溶液PH减小的少,当加水稀释相同的倍数,pH值①>②,
故答案为:=,<,>;
点评 本题考查了电解质电离平衡及其影响因素、溶液PH变化、溶液稀释等知识点,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
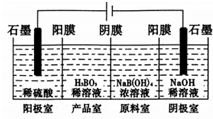
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
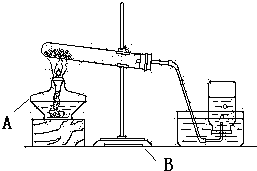
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
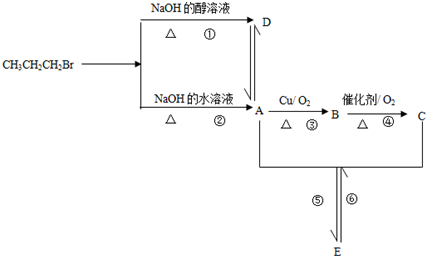
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:戊烷>2,2-二甲基戊烷>2,3-二甲基丁烷>丙烷 | |
| B. | 密度:四氯化碳>乙酸乙酯>水 | |
| C. | 氢元素的质量分数:甲烷>乙烷>乙烯>乙炔 | |
| D. | 等质量物质完全燃烧耗O2量:苯>环已烷>已烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 请根据化学反应Fe+CuCl2=FeCl2+Cu设计一个原电池.限选材料CuCl2(aq),FeCl2 (aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线.
请根据化学反应Fe+CuCl2=FeCl2+Cu设计一个原电池.限选材料CuCl2(aq),FeCl2 (aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A和B的总能量一定高于C和D的总能量 | |
| B. | A的能量一定低于C的,B的能量一定低于D的 | |
| C. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| D. | 破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com