
【题目】2019年诺贝尔化学奖由来自美、英、日的三人分获,以表彰他们在锂离子电池研究方面做出的贡献,他们最早发明用LiCoO2作离子电池的正极,用聚乙炔作负极。回答下列问题:
(1)基态Co原子价电子排布图为______________(轨道表达式)。第四电离能I4(Co)比I4(Fe)小,是因为_____________________。
(2)LiCl的熔点(605℃)比LiF的熔点(848℃)低,其原因是_________________________.
(3)乙炔(C2H2)分子中δ键与π键的数目之比为_______________。
(4)锂离子电池的导电盐有LiBF4等,碳酸亚乙酯(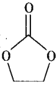 )是一种锂离子电池电解液的添加剂。
)是一种锂离子电池电解液的添加剂。
①LiBF4中阴离子的空间构型是___________;与该阴离子互为等电子体的分子有_____________。(列一种)
②碳酸亚乙酯分子中碳原子的杂化方式有_______________________。
(5)Li2S是目前正在开发的锂离子电池的新型固体电解质,其晶胞结构如图所示,已知晶胞参数a=588pm。
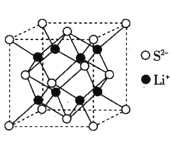
①S2-的配位数为______________。
②设NA为阿伏加德罗常数的值,Li2S的晶胞密度为____________(列出计算式)![]() 。
。
【答案】![]() Co失去的是3d6上的一个电子,而
Co失去的是3d6上的一个电子,而![]() 失去的是半充满状态3d5上的一个电子,故
失去的是半充满状态3d5上的一个电子,故![]() 需要的能量较高 LiCl和LiF均为离子晶体,Cl-半径比F-大,LiCl的晶格能比LiF的小 3:2 正四面体 CF4 sp2、sp3 8
需要的能量较高 LiCl和LiF均为离子晶体,Cl-半径比F-大,LiCl的晶格能比LiF的小 3:2 正四面体 CF4 sp2、sp3 8 ![]()
【解析】
(1)基态Co原子价电子排布式为3d74s2,再得价电子排布图;Co3+为3d6,Fe3+为3d5,Fe3+半满,稳定,难失去电子,因此得到结论。
(2)LiCl与LiF都为离子晶体,主要比较离子晶体中离子半径,键能和晶格能。
(3)乙炔(C2H2)分子中碳碳三键,因此可得分子δ键与π键的数目之比。
(4)①先计算LiBF4中阴离子的电子对,再得空间构型,根据左右价电子联系得出与该阴离子互为等电子体的分子。
②分别分析碳酸亚乙酯分子中每个碳原子的δ键和孤对电子得到结论。
(5)①以最右面中心S2-分析,分析左右连接的锂离子个数。
②先计算晶胞中有几个硫化锂,再根据密度公式进行计算。
(1)基态Co原子价电子排布式为3d74s2,其价电子排布图为![]() ;第四电离能I4(Co)比I4(Fe)小,其Co3+为3d6,Fe3+为3d5,Fe3+半满,稳定,难失去电子,因此原因为Co失去的是3d6上的一个电子,而
;第四电离能I4(Co)比I4(Fe)小,其Co3+为3d6,Fe3+为3d5,Fe3+半满,稳定,难失去电子,因此原因为Co失去的是3d6上的一个电子,而![]() 失去的是半充满状态3d5上的一个电子,故
失去的是半充满状态3d5上的一个电子,故![]() 需要的能量较高,故答案为:
需要的能量较高,故答案为:![]() ;Co失去的是3d6上的一个电子,而
;Co失去的是3d6上的一个电子,而![]() 失去的是半充满状态3d5上的一个电子,故
失去的是半充满状态3d5上的一个电子,故![]() 需要的能量较高。
需要的能量较高。
(2)LiCl的熔点(605℃)比LiF的熔点(848℃)低,它们都为离子晶体,离子晶体熔点主要比较半径,键能和晶格能,因此其原因是LiCl和LiF均为离子晶体,Cl-半径比F-大,LiCl的晶格能比LiF的小,故答案为:LiCl和LiF均为离子晶体,Cl-半径比F-大,LiCl的晶格能比LiF的小。
(3)乙炔(C2H2)分子中碳碳三键,因此分子δ键与π键的数目之比为3:2,故答案为:3:2。
(4)①LiBF4中阴离子的电子对为![]() ,因此空间构型是正四面体型;B-的价电子等于C的价电子,因此与该阴离子互为等电子体的分子有CF4,故答案为:正四面体;CF4。
,因此空间构型是正四面体型;B-的价电子等于C的价电子,因此与该阴离子互为等电子体的分子有CF4,故答案为:正四面体;CF4。
②碳酸亚乙酯分子中碳氧双键的碳原子,δ键有3个,没有孤对电子,因此杂化方式为sp2,另外两个碳原子,δ键有4个,没有孤对电子,因此杂化方式为sp3,所以碳原子的杂化方式有sp2、sp3,故答案为:sp2、sp3。
(5)①以最右面中心S2-分析,连接左边有4个锂离子,右边的晶胞中也应该有4个锂离子,因此配位数为8,故答案为:8。
②设NA为阿伏加德罗常数的值,根据晶胞计算锂离子有8个,硫离子8个顶点算1个,6个面心算3个即总共4个,Li2S的晶胞密度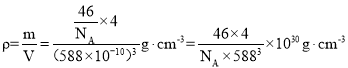 ,故答案为:
,故答案为:![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一定条件下的密闭容器中有如下反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-906 kJ·mol-1,下列叙述正确的是
4NO(g)+6H2O(g) ΔH=-906 kJ·mol-1,下列叙述正确的是
A. 2 mol NH3和5 mol O2充分反应,达到平衡时放出热量为453 kJ
B. 平衡时5v正(O2)=4v逆(NO)
C. 平衡后降低温度,混合气体中NH3含量减小
D. 平衡后减小压强,混合气体平均摩尔质量增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯胺![]() 是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。
是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。
已知:①![]() 和NH3相似,与盐酸反应生成易溶于水的盐
和NH3相似,与盐酸反应生成易溶于水的盐![]()
②用硝基苯制取苯胺的反应原理: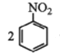 +3Sn+12HCl
+3Sn+12HCl![]()
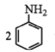 +3SnCl4+4H2O
+3SnCl4+4H2O
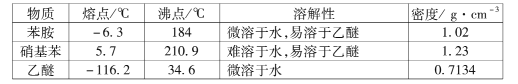
③有关物质的部分物理性质见下表:
I.比较苯胺与氨气的性质
(1)将分别蘸有浓氨水和浓盐酸的玻璃棒靠近,产生白烟,反应的化学方程式为____;用苯胺代替浓氨水重复上述实验,却观察不到白烟,原因是____。
Ⅱ.制备苯胺
往图1所示装置(夹持装置略,下同)的冷凝管口分批加入20mL浓盐酸(过量),置于热水浴中回流20min,使硝基苯充分还原;冷却后,往三颈烧瓶中滴入一定量50% NaOH溶液,至溶液呈碱性。
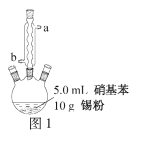
(2)冷凝管的进水口是____(填“a”或“b”);
(3)滴加NaOH溶液的主要目的是析出苯胺,反应的离子方程式为____。
Ⅲ.提取苯胺
i.取出图1所示装置中的三颈烧瓶,改装为图2所示装置。加热装置A产生水蒸气,烧瓶C中收集到苯胺与水的混合物;分离混合物得到粗苯胺和水溶液。
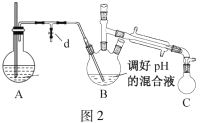
ii.往所得水溶液中加入氯化钠固体,使溶液达到饱和状态,再用乙醚萃取,得到乙醚萃取液。
iii.合并粗苯胺和乙醚萃取液,用NaOH固体干燥,蒸馏后得到苯胺2.79g。
(4)装置B无需用到温度计,理由是____。
(5)操作i中,为了分离混合物,取出烧瓶C前,应先打开止水夹d,再停止加热,理由是____。
(6)该实验中苯胺的产率为____。
(7)欲在不加热条件下除去苯胺中的少量硝基苯杂质,简述实验方案:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设想合成具有以下结构的四种烃分子,下列有关说法不正确的是( )
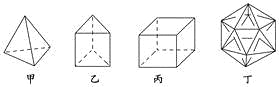
A. 1 mol甲分子内含有10 mol共价键
B. 由乙分子构成的物质不能发生氧化反应
C. 丙分子的二氯取代产物只有三种
D. 分子丁是不可能合成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PET是目前世界上产量最大的聚酯类合成纤维,冬奥会比赛场馆装饰材料、矿泉水瓶、磁带和胶卷的片基等都广泛采用PET材料。以卤代烃为原料合成PET的线路如下(反应中部分无机反应物及产物已省略)。已知RX2(R、R1代表烃基,X代表卤素原子)是芳香族化合物,相对分子质量为175,其中X元素的质量分数为40.6%。
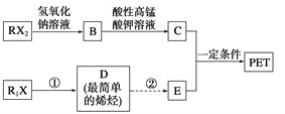
(1)RX2中苯环上有两个取代基,且苯环上的一硝基取代物只有一种。则RX2的结构简式为____________。
(2)1 mol C与足量碳酸氢钠溶液反应可放出________L CO2(标准状况下)。
(3)反应①的化学方程式为______________,其反应类型为________。从D到E,工业上一般通过两步反应来完成。若此处从原子利用率为100%的角度考虑,由D与某种无机物一步合成E,该无机物的化学式为________________。
(4)C的同分异构体M具有:①M分子中,苯环上有三个取代基;②与氯化铁溶液发生显色反应;③与新制氢氧化铜悬浊液在加热条件下反应;④在稀硫酸中能发生水解反应。同时符合上述条件的M的结构有________种。
(5)写出合成PET的化学方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乳酸(PLA),是一种无毒性、可再生、可分解的高分子聚合物塑料,PLA早期是开发在医学上使用,作手术缝合线及骨钉等,现在则已较广泛的应用于一些常见的物品,如:包装袋、纺织纤维,PLA由植物中萃取出淀粉(玉米、甜菜、小麦、甘薯等)或用纤维素(玉米干草、麦杆、甘蔗渣等木质的农业废弃物)经过下列过程制造而成:
淀粉或纤维素![]() 葡萄糖
葡萄糖![]() 乳酸
乳酸![]() 聚乳酸
聚乳酸
根据上述信息,回答下列问题:
(1)淀粉水解生成葡萄糖的化学方程式为_________;
(2)已知1mol葡萄糖![]() 2mol乳酸,转化过程中无其它反应物、生成物,则乳酸的分子式为_________;
2mol乳酸,转化过程中无其它反应物、生成物,则乳酸的分子式为_________;
(3)某研究性小组为了研究乳酸(无色液体,与水混溶)的性质,做了如下实验:
①取1.8g乳酸与过量的饱和NaHCO3溶液反应,测得生成的气体体积为448mL(气体体积已换算为标准状况下体积);
②另取1.8g乳酸与过量的金属钠反应,测得生成的气体体积为448mL(气体体积已换算为标准状况下体积)。
由实验数据推知乳酸分子含有_________(填官能团名称),从以上条件推知乳酸的结构简式可能为_________;
(4)经现代化学仪器分析,测定乳酸分子中含有一个甲基.请写出乳酸分子之间通过酯化反应生成的六元环状化合物的结构简式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A、B、C、D、E、F、G均为有机化合物。
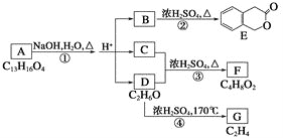
根据上图回答问题:
(1)D、F的化学名称是_______________、_________________。
(2)写出下列反应的化学方程式,并注明反应类型。
②__________,_______________;
④_________,________________。
(3)A的结构简式是_____________,1 mol A与足量的NaOH溶液反应会消耗_____________mol NaOH。
(4)符合下列3个条件的B的同分异构体的数目有__________个。
①含有邻二取代苯环结构
②与B有相同官能团
③不与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验淀粉水解的产物,设计如下实验方案:
![]()
请回答下列问题:
(1)试剂1为20%的H2SO4溶液,其作用是_________;
(2)试剂2为_________NaOH溶液,其作用是_________,使检验水解产物的实验得以顺利进行;发生反应的离子方程式为:_________;
(3)反应①的化学方程式为_________;
(4)为检验淀粉液是否已完全水解,取少量水解液于试管中,加入碘水,则证明淀粉未完全水解的现象是_________;
(5)如果实验过程中没有加入试剂2而直接加入试剂3,能否实现实验目的_________(填”能”或”否”)否,若不能,其原因是_________硫酸能溶解Cu(OH)2而使实验失败,最简单的改正措施是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NSR技术能降低柴油发动机在空气过量条件下NOx的排放,其工作原理如图所示。下列说法错误的是( )
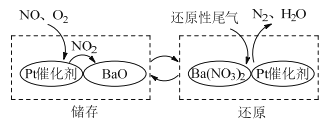
A.降低NOx排放可以减少酸雨的形成
B.储存过程中NOx被氧化
C.还原过程中消耗1molBa(NO3)2转移的电子数为5NA(NA为阿伏加德罗常数的值)
D.通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com