
| A、当x=0.2,则混合溶液中y可能大于7或小于7 |
| B、当x=0.2,y=1,则混合溶液中:c(H+)=c(A2-)+c(OH-) |
| C、当x=0.3,y>7,则混合溶液中:c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+) |
| D、当x=0.4,则混合溶液中:[c(Na+)+c(H+)]>2c(A2-) |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
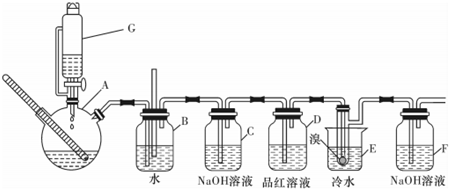
| 乙醇 | 1.2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/(g/cm) | 0.79 | 2.2 | 0.71 |
| 沸点/ | 78.5 | 132 | 34.6 |
| 熔点/ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:
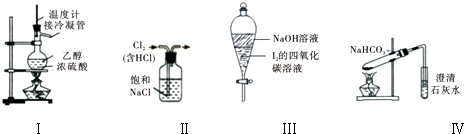
| A、用装置Ⅰ在实验室制备少量乙烯 |
| B、用装置Ⅱ来除去氯气中含有的HCl气体 |
| C、装置Ⅲ中,充分振荡后静置,下层溶液颜色保持不变 |
| D、用装置Ⅳ来探究NaHCO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A. | CO2 (g) | SO2(g) | 饱和Na2CO3溶液、浓H2SO4 | 洗气 |
| B. | NaCl(s) | KNO3(s) | AgNO3溶液 | 过滤 |
| C. | 苯 | 苯酚 | 浓溴水 | 过滤 |
| D. | 苯 | 甲苯 | KMnO4(酸化),NaOH溶液 | 分液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)+H2(g)→
(1)+H2(g)→ (1)-Q ①
(1)-Q ①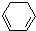 (1)+2H2(g)→
(1)+2H2(g)→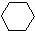 (1)+Q ②
(1)+Q ②| A、反应①、②都属于加成反应 |
| B、1,3-环己二烯比苯稳定 |
| C、反应①、②的热效应说明苯环中含有的并不是碳碳双键 |
| D、反应①、②中的所有有机物均可使溴水褪色,但褪色原理不完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4.8 g |
| B、8.8 g |
| C、9.6g |
| D、14.4g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com