
| A. | N2 | B. | NH4Cl | C. | HCl | D. | NaCl |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,铵根离子和酸根离子之间存在离子键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,据此分析解答.
解答 解:A.氮气分子中N-N原子之间只存在共价键且氮气为单质,故A错误;
B.氯化铵中铵根离子和酸根离子之间存在离子键,N-H原子之间存在共价键,为离子化合物,故B正确;
C.HCl中H-Cl原子之间只存在共价键,为共价化合物,故C错误;
D.氯化钠中钠离子和氯离子之间只存在离子键,为离子化合物,故D错误;
故选B.
点评 本题考查化合物判断,为高频考点,明确离子化合物和共价化合物根本区别是解本题关键,注意不能根据是否含有金属元素判断离子化合物,易错选项是B.


科目:高中化学 来源: 题型:选择题
| A. | O2与O3互为同位素 | |
| B. | O2与O3的相互转化是物理变化 | |
| C. | 等质量的O2与O3含有相同的质子数 | |
| D. | 在相同的温度与压强条件下,等体积的O2与O3含有相同的原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
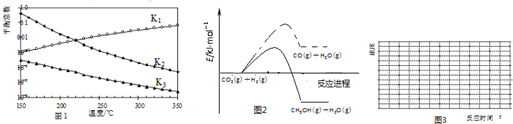
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和烃就是烷烃 | |
| B. | 随着碳原子数的递增,烷烃的熔沸点逐渐降低 | |
| C. | 取代反应中可能有单质生成 | |
| D. | 任何烷烃分子都不可能为平面结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
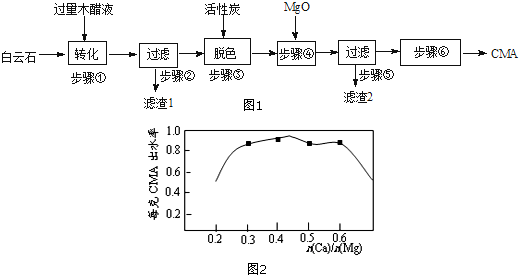
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:pAg=-lg[c(Ag+)],Ksp(AgCl)=1×10-12.如图是向10mLAgNO3溶液中逐滴加入0.1mol•L-1NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图象(实线).根据图象所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )
已知:pAg=-lg[c(Ag+)],Ksp(AgCl)=1×10-12.如图是向10mLAgNO3溶液中逐滴加入0.1mol•L-1NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图象(实线).根据图象所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )| A. | 原AgNO3溶液的物质的量浓度为0.1 mol•L-1 | |
| B. | 图中x点的坐标为(10,6) | |
| C. | 图中x点表示溶液中c(Ag+)=c(Cl-) | |
| D. | 把0.1 mol•L-1的NaCl溶液换成0.1 mol•L-1的NaI溶液,则图象在终点后变为虚线部分 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
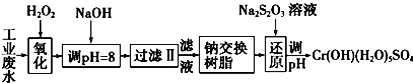
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 37g37Cl2中含有20 NA个质子 | B. | 18 g 2H216O中含有10 NA个电子 | ||
| C. | 26Mg2+中含有10 NA个电子 | D. | 1mol18O中含有10 NA个中子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com