
| A. | CO2 | B. | Na2O | C. | Na2O2 | D. | FeSO4 |
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 11.43 | B. | 22.86g/mol | C. | 80.01 | D. | 80.01g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
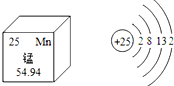 锰(Mn)是维持人体正常生命活动所必须的微量元素,含锰化合物在生产、生活中也被广泛应用.结合图中信息,下列叙述正确的是( )
锰(Mn)是维持人体正常生命活动所必须的微量元素,含锰化合物在生产、生活中也被广泛应用.结合图中信息,下列叙述正确的是( )| A. | 锰原子核内有25个质子,一个锰原子的质量是54.94g | |
| B. | 锰原子核外有4个电子层,其化学性质由最内层电子决定 | |
| C. | MnO2属于氧化物,在H2O2分解制O2的实验中做催化剂 | |
| D. | KMnO4为紫黑色固体,易溶于水、汽油等溶剂,形成紫红色溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2分子的电子式: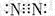 | B. | 中子数为18的氯原子的原子符号: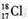 | ||
| C. | 18O2-的结构示意图: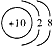 | D. | CO2的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某兴趣小组的同学用如图装置制取漂白液(有效成分为NaClO),并研究其相关性质.
某兴趣小组的同学用如图装置制取漂白液(有效成分为NaClO),并研究其相关性质.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com