

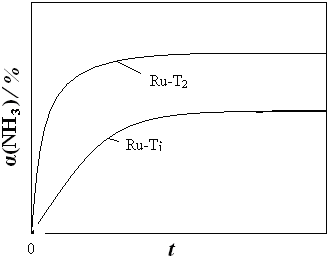
 ��
�� ��
��| c(N2)��c3(H2) |
| c2(NH3) |
| 0.2c0��(0.6c0)3 |
| (0.6c0)2 |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� |
| A���÷�Ӧ�е�������ֻ��Cu2O |
| B��Cu2S�ڷ�Ӧ�м������������ǻ�ԭ�� |
| C��Cu���������������ǻ�ԭ���� |
| D�����������뻹ԭ��������ʵ���֮��Ϊ1��6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| A��13 | B��14 |
| C��15 | D������ȷ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��MnO4-��Mn2+ |
| B��Br-��Br2 |
| C��CO32-��CO2 |
| D��S2-��S |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��X������ͬλ�� |
| B������һ��ͬλ�ص�ԭ��������Ϊ81 |
| C��������Ϊ79��ͬλ�أ���ԭ����������Ϊ50% |
| D��X2��ƽ����Է�������Ϊ159 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
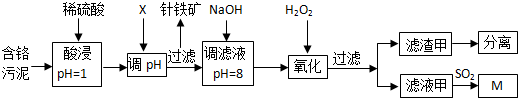
| ������ | Fe3+ | Al3+ | Cu2+ | Mg2+ | Cr3+ |
| ��ʼ����ʱ��pH | 1.9 | 3.7 | 4.7 | 9.3 | --- |
| ������ȫʱ��pH | 3.2 | 8.0 | 6.7 | 11.1 | 9����9�ܽ⣩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��4�� | B��5�� | C��6�� | D��7�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| A�����ʱ�������ĵ缫��ӦΪ��Ni��OH2��+OH--e-=NiO��OH��+H2O |
| B���ŵ�ʱ�������ĵ缫��ӦΪ��H2-2e-+2OH-�T2H2O |
| C���ŵ�ʱ��OH-�������缫 |
| D�����ʱ������ص�̼�缫�����Դ���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 5.56 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com