
| 元素代号 | W | R | X | Y | Z |
| 原子半径/nm | 0.037 | 0.157 | 0.066 | 0.070 | 0.077 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2,+4 |
 CO2↑+4NO2↑+2H2O (2分)
CO2↑+4NO2↑+2H2O (2分)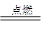 3CO2 (2分)
3CO2 (2分) CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O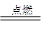 3CO2,再由质量守恒定律可知,该物质化学式为C3O2。故该反应的化学方程式是C3O2+2O2
3CO2,再由质量守恒定律可知,该物质化学式为C3O2。故该反应的化学方程式是C3O2+2O2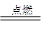 3CO2
3CO2

科目:高中化学 来源:不详 题型:单选题
 He。据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以42He的形式存在。下列关于
He。据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以42He的形式存在。下列关于 He的说法正确的是
He的说法正确的是| A.质量数为3,电子数为3 | B.3He和4He互为同位素 |
| C.质子数为2,电子数为1 | D.质量数为3,中子数为2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.XYZ2 | B.X2YZ3 | C.X2YZ2 | D.XYZ3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Y的最高价氧化物对应的水化物一定是强碱 |
| B.Z一定位于第三周期ⅦA族 |
| C.若X、Y、W可形成化合物XYW2,则该化合物的水溶液呈碱性 |
| D.X与足量的W加热反应会生成化合物X2W |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
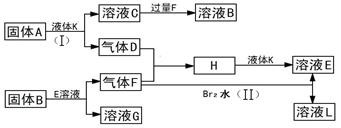
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.酸性:HCl>H2S,所以非金属性:Cl>S |
| B.同周期(除0族)元素原子的最外层电子数越多,越容易得电子,非金属性越强 |
| C.NH3、HNO3都是电解质二者反应后的产物是离子化合物,含极性共价键和离子键 |
| D.原子核外最外层电子数与最内层电子数相等的元素一定是金属元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com