
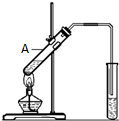
 乙酸是食醋的主要成分,它具有以下化学性质:
乙酸是食醋的主要成分,它具有以下化学性质:分析 (1)乙酸含官能团羧基,乙酸为弱酸,具有酸的通性;
(2)乙醇和乙酸在浓硫酸催化作用下生成乙酸乙酯,乙酸乙酯中含有乙酸、乙醇,易被饱和碳酸钠溶液吸收,注意防止倒吸.
解答 解:(1)乙酸含官能团羧基,乙酸为弱酸,具有酸的通性,可使紫色石蕊变红,与碳酸钠反应的离子方程式为2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑,
故答案为:红;酸;2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑;
(2)醇和乙酸在浓硫酸催化作用下生成乙酸乙酯,故试管中加入试剂有乙醇,反应的化学方程式为CH3COOH+C2H5OH $?_{△}^{浓硫酸}$ CH3COOC2H5+H2O,为酯化反应,
乙酸乙酯中含有乙酸、乙醇,易被饱和碳酸钠溶液吸收,注意防止倒吸,
故答案为:乙醇; CH3COOH+C2H5OH $?_{△}^{浓硫酸}$ CH3COOC2H5+H2O;酯化反应;防止因A试管内液体受热不均匀而引起倒吸.
点评 本题考查了乙酸的性质,为高频考点,侧重于学生的分析、实验能力的考查,题目较基础,注意乙酸的官能团为羧基,乙酸的性质酸性和酯化反应都是羧基所体现的.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下22.4LHF中所含电子数为10NA | |
| B. | 100mL12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.6NA | |
| C. | 1mol•L-1 Na2CO3溶液中,CO32-的数目小于NA | |
| D. | 1 mol CH5+中含有的电子数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
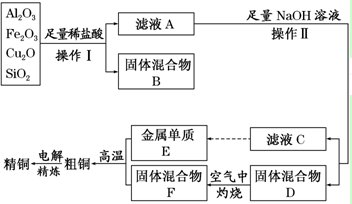
 Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放热使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,做如下实验(假设杂质不参加反应)
Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放热使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,做如下实验(假设杂质不参加反应)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2CO3 BaCl2 NaOH | B. | CaC12 HCl KNO3 | ||
| C. | KOH HCl (NH4)2SO4 | D. | Fe2O3 KCl NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2是硫及某些含硫化合物在空气中燃烧的产物 | |
| B. | SO2有漂白作用,也有杀菌作用 | |
| C. | SO2溶于水后生成H2SO4 | |
| D. | SO2是一种大气污染物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50mL 0.15mol•L-1的BaCl2的溶液 | B. | 50mL 0.3mol•L-1的NaCl溶液 | ||
| C. | 25mL 0.3mol•L-1的FeCl3溶液 | D. | 75mL 0.1mol•L-1的KCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com