
分析 (1)只存在As、O之间的化学键,H3AsO3为酸,含As、O之间和O、H之间的共价键;
(2)由碱金属对应的盐溶于水,其他金属对应的盐几乎不溶于水可知,加CaO发生酸碱中和反应可降低毒性.
解答 解:(1)砒霜中只存在As、O之间的共价键,为共价化合物,H3AsO3为酸,含As、O之间和O、H之间的共价键,为共价化合物,
故答案为:共价;共价;共价;
(2)由碱金属对应的盐溶于水,其他金属对应的盐几乎不溶于水可知,加CaO发生酸碱中和反应可降低毒性,则向该河水中加生石灰可减轻砷对河水的污染,
故答案为:生石灰.
点评 本题考查化学键及应用,为高考常见题型,侧重于学生的分析能力和应用能力的考查,注意把握习题中的信息及化学键判断的一般规律为解答的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ②⑥⑦⑧ | B. | ③④⑤⑥ | C. | ③④⑥⑦ | D. | ①②⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | Z | ||
| X | W |
| A. | 原子半径:X>Z>W | |
| B. | 气态氢化物的稳定性:Y>Z>W | |
| C. | Z、W均可形成含Y元素的离子化合物 | |
| D. | 最高价氧化物对应水化物的酸性:Y>X>W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有些食物中铁元素含量非常丰富,其中非血红素铁是其存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.
有些食物中铁元素含量非常丰富,其中非血红素铁是其存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
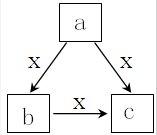 X为一种常见气体(常温下),a,b,c是中学化学常见物质,均由常见元素组成,转化关系如图所示,下列说法不正确的是( )
X为一种常见气体(常温下),a,b,c是中学化学常见物质,均由常见元素组成,转化关系如图所示,下列说法不正确的是( )| A. | 若a、b、c焰色反应均呈黄色,其水溶液均为碱性,则a中可能既含有离子键又含有共价键 | |
| B. | 若X为O2,a为一种固态单质,则c可能为CO2或SO2 | |
| C. | 若b为固态非金属单质,X为气体单质,且b与X所含元素同主族,则a→b、b→c、a→c的反应均为氧化还原反应 | |
| D. | 若a、b、c均含有同一种非金属,且X的水溶液呈碱性,则c可能受热易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
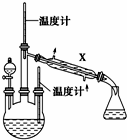 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O):CO(NH2)2+2NaOH+NaClO═Na2CO3+N2H4•H2O+NaCl
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O):CO(NH2)2+2NaOH+NaClO═Na2CO3+N2H4•H2O+NaCl查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com