
| A. | 甲烷和乙烷 | B. | 乙醇和乙酸 | C. | 丙烯和丙烷 | D. | 乙炔和苯蒸气 |
分析 各组混合物中,以任意比例混合,只要总质量固定,经充分燃烧后产生CO2的量为一恒定值,说明混合的两种物质中C元素含量相同,据此分析解答.
解答 解:各组混合物中,以任意比例混合,只要总质量固定,经充分燃烧后产生CO2的量为一恒定值,说明混合的两种物质中C元素含量相同,
A.甲烷和乙烷的分子式分别为CH4、C2H6,两种物质中C元素含量不相同,不符合条件,故A错误;
B.乙醇、乙酸的分子式分别为C2H6O、C2H4O2,两种物质中C含量不同,不符合条件,故B错误;
C.丙烯、丙烷的分子式分别为C3H6、C3H8,两种物质中C含量不同,所以不符合条件,故C错误;
D.乙炔、苯的分子式分别为C2H2、C6H6,二者最简式相同,C含量相同,所以符合条件,故D正确;
故选D.
点评 本题考查混合物的计算,侧重考查学生分析判断能力,明确碳含量与二氧化碳为定值的关系是解本题关键,利用分子式分析解答即可,注意解题方法的灵活性,题目难度不大.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
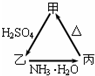 甲、乙、丙三种物质之间有如右图所示的转化关系:
甲、乙、丙三种物质之间有如右图所示的转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
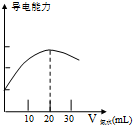 某学习小组用DIS系统测定食用白醋中醋酸的物质的量浓度,以溶液的导电能力来判断滴定终点.实验步骤如下:
某学习小组用DIS系统测定食用白醋中醋酸的物质的量浓度,以溶液的导电能力来判断滴定终点.实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
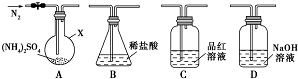
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40K和40Ca原子中的质子数和中子数都相等 | |
| B. | 任何元素的原子都是由核外电子和核内中子、质子组成的 | |
| C. | 具有相同核电荷数的粒子,一定是同种原子的微粒 | |
| D. | 同种元素的不同核素之间互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、Cl-、CO32- | B. | NH4+、Na+、Cl-、SO42- | ||
| C. | Na+、HCO3-、NO3-、SO42- | D. | K+、MnO4-、Na+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用浸泡过高锰酸钾溶液的硅土吸收水果释放的乙烯,可达到水果保鲜的目的 | |
| B. | 在结冰的路面上撒盐,是利用盐与水发生化学反应放出大量热量,促使冰雪融化 | |
| C. | 食盐是咸味剂,工业上常用电解饱和食盐水制备氯气和钠 | |
| D. | 太阳能电池板中的硅是二氧化硅,光导纤维的主要成分是硅单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com