
向两支分别盛有0.1 mol/L醋酸和饱和硼酸(H3BO3)溶液的试管中滴加等浓度碳酸钠溶液,实验现象为(1)________,三种酸由强到弱的顺序是(用化学式表示)(2)________,硼酸(H3BO3)在食品、医药领域应用广泛.
(3)请完成B2H6气体与水反应的化学方程式:B2H6+6H2O=2H3BO3+________.
(4)在其他条件相同时,反应H3BO3+3CH3OH B(OCH3)3+3H2O中,H3BO3的转化率(α)在不同温度下随反应时间(t)的变化见下图,由此图可得出:
B(OCH3)3+3H2O中,H3BO3的转化率(α)在不同温度下随反应时间(t)的变化见下图,由此图可得出:
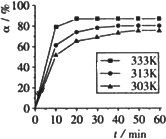
①温度对应该反应的反应速率和平衡移动的影响是________.
②该反应的ΔH________0(填“<”、“=”或“>”).
(5)H3BO3溶液中存在如下反应:H3BO3(aq)+H2O(l) [B(OH)4]-(aq)+H+(aq)
[B(OH)4]-(aq)+H+(aq)
已知0.70 mol·L-1 H3BO3溶液中,上述反应于298 K达到平衡时,c平衡(H+)=2.0×10-5 mol·L-1,c平衡(H3BO3)≈c起始(H3BO 3),水的电离可忽略不计,此温度下该反应的平衡常数K=________,(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源:江苏省平潮高级中学2006-2007学年度第一学期期中考试、高二化学试卷 题型:058
| |||||||||||||||
查看答案和解析>>
科目:高中化学 来源:2011-2012学年黑龙江省大庆实验中学高二上学期期中考试化学试卷 题型:填空题
向两支分别盛有0.1mol/L醋酸和饱和硼酸(H3BO3)溶液的试管中滴加等浓度碳酸钠溶液,实验现象为(1) 三种酸由强到弱的顺序是(用化学式表示)(2) ,]硼酸(H3BO3)在食品、医药领域应用广泛。
(3) 请完成B2H6气体与水反应的化学方程式:B2H6 +6H2O=2H3BO3 +________。
(4) 在其他条件相同时,反应H3BO3 +3CH3OH  B(OCH3)3 +3H2O中,H3BO3的转化率(
B(OCH3)3 +3H2O中,H3BO3的转化率(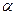 )在不同温度下随反应时间(t)的变化见下图,由此图可得出:
)在不同温度下随反应时间(t)的变化见下图,由此图可得出: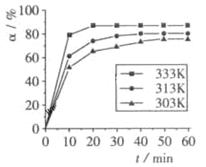
①温度对应该反应的反应速率和平衡移动的影响是____ ___
②该反应的 _____0(填“<”、“=”或“>”).
_____0(填“<”、“=”或“>”).
(5) H3BO 3溶液中存在如下反应: H3BO 3(aq)+H2O(l) [B(OH)4]-( aq)+H+(aq)
[B(OH)4]-( aq)+H+(aq)
已知0.70 mol·L-1 H3BO 3溶液中,上述反应于298K达到平衡时,c平衡(H+)="2." 0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可忽略不计,此温度下该反应的平衡常数K= ,
(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:实验题
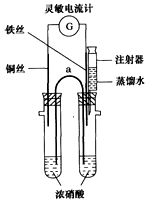
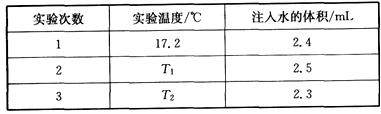
查看答案和解析>>
科目:高中化学 来源:2011-2012学年湖北省部分重点中学高二上学期期中联考化学试卷 题型:实验题
(9分)为比较Fe3+、Cu2+和MnO2对H2O2分解反应的催化效果 ,某化学研究小组的同学分别设计了如图甲、乙、丙所示的实验。请回答相关问题:
,某化学研究小组的同学分别设计了如图甲、乙、丙所示的实验。请回答相关问题: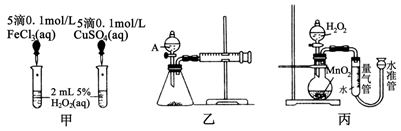
(1)同学X观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果。其结论________(填“合理”或“不合理”)。理由是_______________________。
(2)同学Y利用乙装置,测定相同时间内产生气体的体积,从而探究Fe3+和Cu2+对H2O2分解的催化效果。试回答下列问题:
①仪器A的名称是____ ____。
____。
②除了必要的试剂和图乙所示的仪器外,还有一样不能缺少的实验用品是___________。
③实验时组装好装置乙,关闭A的活塞,将注射器活塞向外拉出一段。这一操作的实验目的是_______________________。
④测定气体体积时,是否需要事先排除乙装置内的空气________(填“需要”或“不需要”)。
(3)同学Z利用丙装置探究MnO2对H2O2分解的催化效果。将50 mL 双氧水一次性加入盛有0.10 mol MnO2粉末的烧瓶中,测得标准状况下由量气管读出气体的体积[V(量气管)]和
时间(t/min)的关系如图所示。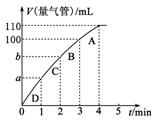
①实验时放出气体的总体积是________mL。
②b________(填“大于”、“小于”或“等于”)90 mL。
③同学Z除了探究MnO2对H2O2分解速率的影响情况,
还可得出________对H2O2分解速率的影响情况。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com