
(14分)某化学反应2A B+D在四种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率V(B)为 mol/(L·min)。
(2)在实验2,A的初始浓度C2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1(填>、=、<),且C3 1.0mol/L(填>、=、<)
(4)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
(本题14分)某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中加入l—2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe>Br2,故上述实验现象不是发生化学反应所致,则溶液里黄色是含 (填化学式,下同)所致。
②乙同学认为氧化性:Fe<Br2,故上述实验现象是发生化学反应所致,则溶液呈黄色是含 所致。
(3)设计实验并验证
丙同学为验证乙同学的观点。选用下列某些试剂设计两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
供选用的试剂:a、酚酞试液 b、四氯化碳 c、无水酒精 d、硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
|
| 选用试剂(填序号) | 实验现象 |
| 方案1 |
|
|
| 方案2 |
|
|
(4)结论
氧化性:Fe<Br2,在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为 。
(5)实验后的思考
在2molFeBr2溶液中通入一定量的Cl2,当有33.6L Cl2(标准状况)与FeBr2溶液发生了反应,所发生反应的离子反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省枣强县中学高一下学期期末考试化学试卷(带解析) 题型:填空题
(14分)阅读讨论并完成以下各项内容:
SO2是常见的大气污染物之一,我国规定空气中SO2含量不得超过0.02 mg/L。
(1)酸雨是降水呈酸性(pH小于5.6)的统称,个别地方甚至低于2.1(食醋的pH=3)。引起酸雨的罪魁祸首是大气中的SO2和氮的氧化物。它们的主要来源是煤和石油的燃烧,全世界每年排放1.5亿吨的SO2。
①SO2可在空气中受光照等因素作用而被氧化,最终与雨水形成硫酸型酸雨。试写出这两个化学反应的方程式
________________________________________________________________________;
________________________________________________________________________。
②汽车排放的尾气、硝酸厂和化肥厂的废气中都含有氮的氧化物,全世界每年排放量约为5×107 kg。NO2溶于水生成 ________和NO。
③酸雨可导致的危害有________(填序号)。
A.腐蚀建筑物 B.导致树木枯萎
C.造成洪涝灾害 D.恶化人类环境
④为了减少酸雨的形成,必须减少SO2的排放量,对燃料中的硫化物进行________,对废气中的氮的氧化物用________吸收。
(2)某化学兴趣小组选用下图实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量(已知碘能氧化H2SO3,生成H2SO4)。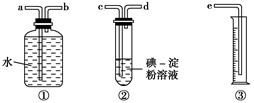
①若原料气从左向右流时,上述装置连接的顺序是:原料气→________(用字母和箭头表示)。
②装置②中发生反应的离子方程式为:
________________________________________________________________________;
当装置②中出现________现象时,立即停止通气。
③你认为下列试剂中,可以用来代替试管中的碘的淀粉溶液的是________。
A.酸性KMnO4溶液 B.NaOH溶液
C.溴水 D.氨水
查看答案和解析>>
科目:高中化学 来源:2014届广东省罗定市高一下学期期中质检理综化学试卷(解析版) 题型:填空题
(14分)
I、人们常利用化学反应中的能量变化为人类服务。
(1)煤是一种重要的燃料,在点燃条件下燃烧,放出大量的热。其在燃烧过程中能量的变化与如图所示中的 (填字母代号)最相符。
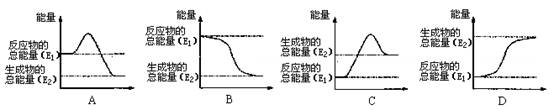 (2)将一定量的碳酸钠晶体与硝酸铵晶体密封于一塑料袋中,用线绳绑住塑料袋中间部分,使两种晶体隔开,做成“冰袋”。使用时将线绳解下,用手使袋内两种固体粉末充分混合,便立即产生低温,这种“冰袋”可用于短时间保鲜食物。则碳酸钠与硝酸铵的总能量_____________(填“高于”或“低于”)反应后生成产物的总能量。[来源:Zxxk.Com]
(2)将一定量的碳酸钠晶体与硝酸铵晶体密封于一塑料袋中,用线绳绑住塑料袋中间部分,使两种晶体隔开,做成“冰袋”。使用时将线绳解下,用手使袋内两种固体粉末充分混合,便立即产生低温,这种“冰袋”可用于短时间保鲜食物。则碳酸钠与硝酸铵的总能量_____________(填“高于”或“低于”)反应后生成产物的总能量。[来源:Zxxk.Com]
(3)化学反应中的能量变化不仅仅表现为热能的变化,有时还可以表现为其它形式的能量变化。比如,停电时,人们一般点蜡烛来照明,这主要是将化学能转化为 ;人们普遍使用的干电池,是将化学能转化为 。
II、某同学在超市看到一种电池外壳的纸层包装印有如获至宝图的文字,请根据要求回答问题。

(1)该电池的种类是__ ___(填序号)。[来源:Z,xx,k.Com]
①干电池 ②蓄电池 ③燃料电池
(2)该电池含有的金属元素中毒性最大的是_ __ __ (写元素符号)。
(3)该电池的使用和性能,说法正确的是__ ___
A.该电池可应用于闹钟、收音机、照相机等
B.该电池可充电后反复使用
C.该电池使用后不能投入火中,应埋入地下以防污染环境
查看答案和解析>>
科目:高中化学 来源:2010-2011学年湖北省高三联合体大联考理科综合化学部分 题型:实验题
(本题14分)某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中加入l—2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe 、Br2谁的氧化性更强?
、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe >Br2,故上述实验现象不是发生化学反应所致,则溶液里黄色是含
(填化学式,下同)所致。
>Br2,故上述实验现象不是发生化学反应所致,则溶液里黄色是含
(填化学式,下同)所致。
②乙同学认为氧化性:Fe <Br2,故上述实验现象是发生化学反应所致,则溶液呈黄色是含
所致。
<Br2,故上述实验现象是发生化学反应所致,则溶液呈黄色是含
所致。
(3)设计实验并验证
丙同学为验证乙同学的观点。选用下列某些试剂设计两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
供选用的试剂:a、酚酞试液 b、四氯化碳 c、无水酒精 d、硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
|
|
选用试剂(填序号) |
实验现象 |
|
方案1 |
|
|
|
方案2 |
|
|
(4)结论
氧化性:Fe <Br2,在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为
。
<Br2,在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为
。
(5)实验后的思考
在2molFeBr2溶液中通入一定量的Cl2,当有33.6L Cl2(标准状况)与FeBr2溶液发生了反应,所发生反应的离子反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(本题14分)某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中加入l—2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe![]() 、Br2谁的氧化性更强?
、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe![]() >Br2,故上述实验现象不是发生化学反应所致,则溶液里黄色是含 (填化学式,下同)所致。
>Br2,故上述实验现象不是发生化学反应所致,则溶液里黄色是含 (填化学式,下同)所致。
②乙同学认为氧化性:Fe![]() <Br2,故上述实验现象是发生化学反应所致,则溶液呈黄色是含 所致。
<Br2,故上述实验现象是发生化学反应所致,则溶液呈黄色是含 所致。
(3)设计实验并验证
丙同学为验证乙同学的观点。选用下列某些试剂设计两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
供选用的试剂:a、酚酞试液 b、四氯化碳 c、无水酒精 d、硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
| 选用试剂(填序号) | 实验现象 | |
| 方案1 | ||
| 方案2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com