

分析 菱锰矿用稀硫酸溶解,MnCO3、FeCO3、Al2O3都和稀硫酸反应生成硫酸盐,SiO2不反应,酸性条件下,加入MnO2将Fe2+氧化为Fe3+,MnO2还原生成Mn2+,调节溶液的pH,使Fe3+、Al3+完全转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤渣1为SiO2、Al(OH)3、Fe(OH)3,滤液中存在 MnSO4、硫酸钠等,加入碳酸氢铵得到MnCO3,过滤分离,滤液2中含有硫酸铵、硫酸钠等.
(1)滤渣1中,含铁元素的物质主要是氢氧化铁;加NaOH调节溶液的pH约为5,如果pH过大,可能导致滤渣1中氢氧化铝、二氧化硅溶解;
(2)滤液2中含有硫酸铵、硫酸钠等;
(3)①Mn2+被氧化,(NH4)2S2O8中S元素还原为硫酸根;
②由Mn元素守恒、电子转移守恒,可得关系式:Mn2+~MnO4-~5Fe2+,结合关系式计算;
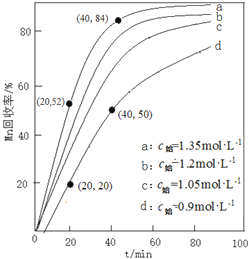
(4)①由图可知,NH4HCO3初始浓度越大,锰元素回收率越高;NH4HCO3初始浓度越大,溶液中碳酸根离子浓度越大,根据溶度积可知溶液c(Mn2+)越小;
②若溶液中c(Mn2+)=1.0 mol•L-1,加入等体积1.8 mol•L-1NH4HCO3溶液进行反应,混合后NH4HCO3溶液浓度为0.9mol/L,为图象中d曲线,根据回收率可以计算△c(Mn2+),进而计算20~40 min内v(Mn2+).
解答 解:菱锰矿用稀硫酸溶解,MnCO3、FeCO3、Al2O3都和稀硫酸反应生成硫酸盐,SiO2不反应,酸性条件下,加入MnO2将Fe2+氧化为Fe3+,MnO2还原生成Mn2+,调节溶液的pH,使Fe3+、Al3+完全转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤渣1为SiO2、Al(OH)3、Fe(OH)3,滤液中存在 MnSO4、硫酸钠等,加入碳酸氢铵得到MnCO3,过滤分离,滤液2中含有硫酸铵、硫酸钠等.
(1)滤渣1中,含铁元素的物质主要是Fe(OH)3;加NaOH调节溶液的pH约为5,如果pH过大,可能导致滤渣1中SiO2、Al(OH)3溶解,导致滤渣1中SiO2、Al(OH)3减小,
故答案为:Fe(OH)3;SiO2、Al(OH)3;
(2)滤液2中含有硫酸铵、硫酸钠等,+1价阳离子除了H+外还有:Na+、NH4+,
故答案为:Na+、NH4+;
(3)①Mn2+被氧化,(NH4)2S2O8中S元素还原为SO42-,
故答案为:SO42-;
②由Mn元素守恒、电子转移守恒,可得关系式:Mn2+~MnO4-~5Fe2+,则n(Mn2+)=$\frac{1}{5}$n(Fe2+),所以c(Mn2+)=$\frac{\frac{1}{5}×V×1{0}^{-3}L×bmol/L}{a×1{0}^{-3}L}$=$\frac{bV}{5a}$mol/L,
故答案为:$\frac{bV}{5a}$;
(4)①由图可知,NH4HCO3初始浓度越大,锰元素回收率越高,NH4HCO3初始浓度越大,溶液中c(CO32-)度越大,根据溶度积Ksp(MnCO3)=c(Mn2+)×c(CO32-)可知溶液c(Mn2+)越小,析出的MnCO3越多,
故答案为:高;NH4HCO3初始浓度越大,溶液中c(CO32-)度越大,根据溶度积Ksp(MnCO3)=c(Mn2+)×c(CO32-)可知溶液c(Mn2+)越小,析出的MnCO3越多;
②若溶液中c(Mn2+)=1.0 mol•L-1,加入等体积1.8 mol•L-1NH4HCO3溶液进行反应,混合后NH4HCO3溶液浓度为0.9mol/L,为图象中d曲线,20~40 min内△c(Mn2+)=1mol/L×$\frac{1}{2}$×(50%-20%)=0.15mol/L,则20~40 min内v(Mn2+)=$\frac{0.15mol/L}{(40-20)mol}$=0.0075mol/(L.min),
故答案为:0.0075mol/(L.min).
点评 本题考查物质准备工艺流程,涉及混合物的分离和提纯、氧化还原反应滴定、信息获取与迁移运用等,侧重考查学生对知识的综合运用能力,需要学生具备扎实的基础,题目难度中等.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨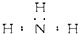 | |
| B. | 四氯化碳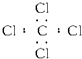 | |
| C. | 氮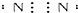 | |
| D. | 二氧化碳${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$C${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨气化吸收大量热,可做制冷剂 | |
| B. | 晶体硅用于制作半导体材料是因其熔点高、硬度大 | |
| C. | 二氧化锰具有强氧化性,故能将双氧水氧化为氧气 | |
| D. | Fe比Cu活泼,所以FeCl3溶液可以腐蚀线路板上的Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
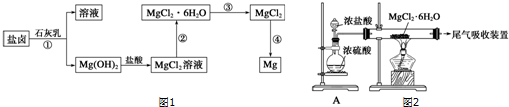
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I A | II A | III A | IV A | V A | VI A | VII A | 0 | |
| 一 | A | |||||||
| 二 | B | C | D | E | F | |||
| 三 | G | H | I | |||||
| 四 | J |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11种 | B. | 12种 | C. | 13种 | D. | 14种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
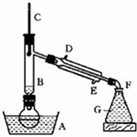 溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:
溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:| 物质 数据 | 乙醇 | 溴乙烷 | 1,2-二溴乙烷 | 乙醚 | 浓硫酸 |
| 密度/g•cm-3 | 0.79 | 1.46 | 2.2 | 0.71 | 1.84 |
| 熔点(℃) | -130 | -119 | 9 | -116 | 10 |
| 沸点(℃) | 78.5 | 38.4 | 132 | 34.6 | 338 |
| 在水中的溶解度(g/100g水) | 互溶 | 0.914 | 1 | 7.5 | 互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液与氢氧化铜反应:2CH3COOH+Cu(OH)2 Cu2++2CH3COO-+2H2O | |
| B. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O$\stackrel{△}{→}$2C6H5OH+CO32- | |
| D. | 甲酸溶液与足量的银氨溶液共热HCOOH+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com