
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑨ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
 .
.分析 由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Mg、⑦Al、⑧为Si、⑨为F,
(1)同周期从左向右金属性减弱,非金属性增强;同主族从上到下金属性增强,非金属性减弱;
(2)电子层越多,原子半径越大;同周期从左向右原子半径减小;
(3)非金属性越强,最高价氧化物的水化物的酸性越强;
(4)①、④元素按原子个数比2:1组成的化合物为水;
(5)由②和④组成的化合物与⑥单质反应生成MgO和C;
(6)⑦单质为Al,与⑤的最高价氧化物的水化物为NaOH,反应生成偏铝酸钠和氢气.
解答 解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Mg、⑦Al、⑧为Si、⑨为F,
(1)同周期从左向右金属性减弱,非金属性增强;同主族从上到下金属性增强,非金属性减弱,则①~⑨中金属性最强的元素是Na,非金属性最强的元素是F,
故答案为:Na;F;
(2)电子层越多,原子半径越大;同周期从左向右原子半径减小,则④、⑤、⑦的原子半径由大到小的顺序为Na>Al>O,
故答案为:Na>Al>O;
(3)非金属性越强,最高价氧化物的水化物的酸性越强,则②、③的最高价氧化物的水化物的酸性强弱顺序为HNO3>H2CO3,
故答案为:HNO3>H2CO3;
(4)①、④元素按原子个数比2:1组成的化合物为水,电子式为 ,故答案为:
,故答案为: ;
;
(5)由②和④组成的化合物与⑥单质反应生成MgO和C,反应为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(6)⑦单质为Al,与⑤的最高价氧化物的水化物为NaOH,反应生成偏铝酸钠和氢气,离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
点评 本题考查元素位置、结构与性质的关系,为高频考点,把握元素的位置、元素的性质及元素周期律为解答的关键,侧重分析与应用能力的考查,注意元素周期律及元素化合物知识的综合应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,它属于( )
,它属于( )| A. | 无机物 | B. | 烃 | C. | 高分子化合物 | D. | 有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>R>W | |
| B. | 气态氢化物稳定性:HnW>HmR | |
| C. | X2W6分子中各原子最外层电子均满足8电子结构 | |
| D. | Y、Z形成的化合物中只含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
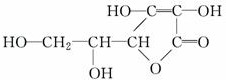
| A. | 易起氧化及加成反应 | B. | 在碱性溶液中不能稳定地存在 | ||
| C. | 难溶解于水 | D. | 是一个环状的酯类化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、C、D最高价氧化物对应的水化物两两之间能发生反应 | |
| B. | D和A能形成原子个数比为2:1型的离子化合物 | |
| C. | 最高价氧化物对应的水化物的酸性:B>A | |
| D. | C的氧化物是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔗糖、淀粉、油脂及其水解产物均为非电解质 | |
| B. | 沼气的利用,玉米制乙醇都涉及生物质能的利用 | |
| C. | 氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理 | |
| D. | pH计可用于酸碱中和滴定终点和乙酸乙酯的水解程度的判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com