
【题目】我国具有丰富的锑矿资源,锑及其化合物被广泛应用于机械材料、塑料、阻燃剂、微电子技术等领域,具有十分重要的价值。利用脆硫铅锑精矿(主要成分是Sb2S3及PbS)制备锑白(Sb2O3)的工艺流程如图所示。

已知:浸出反应Sb2S3+3Na2S = 2Na3SbS3
酸化反应4Na3SbS3 +9SO2=6Na2S2O3+3S↓+2Sb2S3↓
回答下列问题。
(1)精矿进行研磨的目的是___________________。
(2)在浸出反应中,浸出率随NaOH用量的变化曲线如图所示,其中NaOH的作用是_______________________。

(3)向浸出液中通入SO2气体进行酸化,得到Sb2S3中间体。酸化反应过程中,pH对锑沉淀率及酸化后溶液中Na2S2O3含量的影响如下表所示,则最适宜的pH为__________。 pH不能过低的原因是_______________(结合离子方程式说明)。
pH | 酸化后溶液成分/(g·L-1) | 锑的沉淀率/% | |
Sb | Na2S2O3 | ||
6 | 0.6 | 160.5 | 99.5 |
7 | 2.7 | 157.6 | 97.5 |
8 | 5.6 | 150.4 | 95.4 |
9 | 10.5 | 145.0 | 92.4 |
(4)浸出液酸化后过滤,得到沉淀混合物,在高温下被氧化,写出所有反应的化学方程式:_____________。
(5)从尾气处理的角度评价该工艺流程在环保方面的优点是__________________。
【答案】增大反应物的接触面积,加快反应速率,提高浸出率 提供碱性环境,减少Na2S的水解 6 pH较低时发生反应S2O32-+2H+=S↓+SO2↑+H2O,会造成Na2S2O3损耗 2Sb2S3+9O2![]() 2Sb2O3+6SO2,S+O2
2Sb2O3+6SO2,S+O2![]() SO2 SO2可以循环利用,减少环境污染
SO2 SO2可以循环利用,减少环境污染
【解析】
(1)将精矿进行研磨有助于增加反应的接触面积,加快反应速率,提高Sb的浸出率;
(2)浸出时加入Na2S溶液中的S2-会发生水解,当加入NaOH时,溶液呈碱性,可以抑制S2-的水解;
(3)从表中可以看出,当pH=6时,溶液中的Sb含量最少,沉淀率最大,故最适宜的pH选择6;如果pH过低,酸化后生成的S2O32-可以与溶液中的H+反应生成S沉淀,影响Na2S2O3的产率。
(4)酸化后的沉淀为Sb2S3和S的混合物,在高温下与氧气发生反应生成SO2和Sb2O3,相应的反应方程式为2Sb2S3+9O2![]() 2Sb2O3+6SO2,S+O2
2Sb2O3+6SO2,S+O2![]() SO2;
SO2;
(5)沉淀氧化后有SO2气体生成,将气体通入到酸化溶液中循环利用可以减少环境污染。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】钠、镁、铝的单质及其化合物是中学阶段重点研宄的物成.
(1)按性质分类,Na2O2____________(填“属于”或“不属于”)碱性氧化物。
(2)用离子方程式说明Al(OH)3是两性氢氧化物: ____________________。
(3)某同学用如图所示装置进行实验探究有关钠、镁、铝的化合物的性质(夹持仪器省略)。将液体A遂满加入到固体B中,回答下列问题:
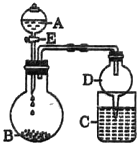
①若A为70%硫酸溶液,B为Na2SO3,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中发生反应的化学方程式为________________________。
②若A为水,B为Mg3N2,C中盛有AlC13溶液,旋开E,足够长的时间后,C中发生反应的离子方程式为__________________________。
③若A为浓盐酸,B为NaClO3,C中盛有KI-淀粉溶液,旋开E后,C中的现象是________________,继续通气体于C中,足够长的时间后,发现C中溶液的颜色消失,这是因为在溶液中I2能被Cl2氧化为HIO3,写出该反应的化学方程式: _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列说法正确的是( )
A. 100 mL 1 mol·L-1FeCl3溶液中所含Fe3+的数目为0.1NA
B. 常温常压下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
C. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
D. 标准状况下,124 g P4中所含P—P键数目为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家对一碳化学进行了广泛深入的研究并取得了一些重要成果。
(1)已知:CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1kJ/mol;
CH3OH(g) △H1=-90.1kJ/mol;
3CH3OH(g)![]() CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol
CO与H2合成CH3CH=CH2的热化学方程式为________。
(2)现向三个体积均为2L的恒容密闭容器I、II、Ⅲ中,均分别充入1molCO 和2mo1H2发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图1所示,其中只有一个容器中的反应已经达到平衡状态。
CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图1所示,其中只有一个容器中的反应已经达到平衡状态。

①5min时三个容器中的反应达到化学平衡状态的是容器_______(填序号)。
②0-5 min内容器I中用CH3OH表示的化学反应速率v(CH3OH)=_______。(保留两位有效数字)
(3)CO常用于工业冶炼金属,在不同温度下用CO 还原四种金属氧化物,达到平衡后气体中lgc(CO)/c(CO2)与温度(T)的关系如图2所示。下列说法正确的是_____(填字母)。
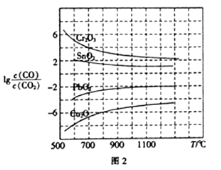
A.工业上可以通过增高反应装置来延长矿石和CO接触面积,减少尾气中CO的含量
B.CO用于工业冶炼金属铬(Cr)时,还原效率不高
C.工业冶炼金属铜(Cu) 时,600℃下CO的利用率比1000℃下CO的利用率更大
D.CO还原PbO2的反应△H>0
(4)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。
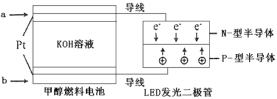
请写出加入(通入)a物质一极的电极反应式___________;每消耗6.4g甲醇转移的电子数为__________。
(5)一定条件下,用甲醇与一氧化碳反应合成乙酸可以消除一氧化碳污染。常温下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合后,若溶液呈中性,用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用电催化N2还原法制取NH3的反应机理如图所示,其中*表示吸附在催化剂表面的物种。下列说法正确的是
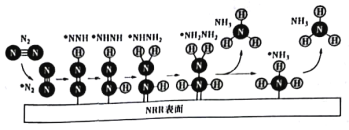
A.两个氮原子上的加氢过程是分步进行的
B.析氢反应(H++ H+→H2)不会影响NH3的合成
C.NH3从催化剂表而脱附不利于NH3的合成
D.电催化法是一步即能把N2还原为NH3的高效还原法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,取下列四种有机物各1mol,分别在足量的氧气中燃烧,消耗氧气最多的是
A. C2H5OH B. CH4 C. C2H4O D. C3H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置制备溴苯,下列说法错误的是

A. 装置A中长玻璃导管仅起冷凝回流作用,装置B中的实验现象是CCl4由无色变橙色
B. 若装置B后连接装置C,装置C中生成淡黄色沉淀,可证明装置A中发生取代反应
C. 若装置B后连接装置D,则装置D的作用是吸收尾气
D. 向反应后的装置A中加入NaOH溶液,振荡静置,下层为无色油状液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知4NH3+5O2═4NO+6H2O,反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,正确的是( )
A.4/5v(O2)= v(NO)
B.5/6v(O2)= v(H2O)
C.2/3v(NH3)= v(H2O)
D.4/5v(NH3)= v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。
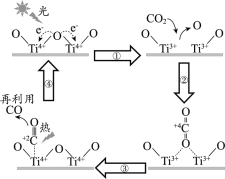

下列说法正确的是
A.过程①中钛氧键断裂会释放能量
B.该反应中,光能和热能转化为化学能
C.使用TiO2作催化剂可以降低反应的焓变,从而提高化学反应速率
D.CO2分解反应的热化学方程式为2CO2(g) =2CO(g) + O2(g) ΔH= + 30 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com