
室温下,用0.1mol/L氨水分别滴定20.0mL、0.1mol/L的盐酸和醋酸,曲线如图所示,下列说法正确的( )

|
| A. | I曲线表示的是滴定盐酸的曲线 |
|
| B. | x=20 |
|
| C. | 滴定过程中 |
|
| D. | 当I曲线和II曲线pH均为7时,一溶液中的c(Cl﹣)等于另一溶液中的c(CH3COO﹣) |
| 中和滴定.. | |
| 专题: | 电离平衡与溶液的pH专题. |
| 分析: | A.0.1mol/L的盐酸的pH=1,结合滴定曲线开始时的pH来判断; B.根据两者恰好反应生成氯化铵,氯化铵水解溶液呈酸性,要使溶液呈中性,则氨水应过量; C.根据氨水的电离平衡常数只与温度有关以及c(OH﹣)在增大; D.根据当I曲线和II曲线pH均为7时,在盐酸中,氨水过量,在醋酸中,氨水恰好反应,根据溶液中电荷守恒来解答. |
| 解答: | 解:A.滴定开始时0.1mol/L盐酸pH=1,0.1mol/L醋酸pH>1,所以滴定盐酸的曲线是图Ⅱ,滴定醋酸的曲线是图Ⅰ,故A错误; B.用0.1mol/L氨水滴定20.0mL、0.1mol/L的盐酸,两者恰好反应,消耗20.0mL、0.1mol/L氨水,但反应生成氯化铵,氯化铵水解溶液呈酸性,所以溶液呈中性,碱应过量,故B错误; C.NH3•H2O的电离常数Kb= D.当I曲线和II曲线pH均为7时,分别存在电离平衡:c(NH4+)+c(H+)=c(Cl﹣)+c(OH﹣);c(NH4+)+c(H+)=c(CH3COO﹣)+c(OH﹣),都存在:c(H+)=c(OH﹣),所以c(NH4+)=c(Cl﹣),c(NH4+)=c(CH3COO﹣),在盐酸中,氨水过量,在醋酸中,氨水恰好反应,所以盐酸中c(NH4+)大,则c(Cl﹣)>c(CH3COO﹣),故D错误; 故选C. |
| 点评: | 本题考查酸碱混合溶液酸碱性判断及溶液中离子浓度大小比较,涉及盐类的水解、电离常数等知识,注意醋酸铵溶液呈中性,题目难度中等 |


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
0.2 mol有机物与0.5 mol O2恰好完全燃烧后的产物为CO2和H2O(g)。产物经过浓硫酸后,浓硫酸的质量增加10.8 g;再通过碱石灰剩余气体被完全吸收,碱石灰质量增加17.6 g。
(1)燃烧后产物的物质的量分别为CO2________mol、H2O(g)__________mol。
(2)推断该有机物的分子式为_____________。
(3)若0.2 mol该有机物恰好与9.2 g金属钠完全反应,其核磁共振氢谱显示只有两种
不同环境的H,试确定该有机物的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
钛酸钡粉体是电子陶瓷元器件的重要基础原料。工业以草酸盐共沉淀法获得草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧可获得钛酸钡粉体。
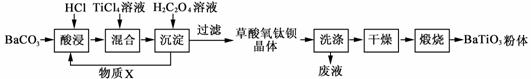
(1)酸浸时发生的反应的离子方程式为 ▲ ;为提高BaCO3的酸浸率,可采取的措施为 ▲ (任答一点)。
(2)煅烧草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O]得到BaTiO3的同时,生成高温下的气体产物有CO、 ▲ 和 ▲ 。
(3)加入H2C2O4溶液时,发生反应的化学方程式为 ▲ ;
可循环使用的物质X是 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图X、Y、A、B、C均为短周期主族元素,其中只有一种是金属元素,则下列说法错误是( )
| X | A | ||
| Y | C | B |
|
| A. | 原子半径大小:Y>C>X>A |
|
| B. | Y和B形成的化合物中Y和B的原子个数比为2:3 |
|
| C. | X、C、A中最高价氧化物对应的水化物的酸性最强的是A |
|
| D. | A、B均为非金属元素,所以两者的氢化物相遇不发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是 ( )
A.s区元素都是金属元素 B.p区元素全部都是非金属元素
C.d区、ds区和f区由副族元素组成 D.s区和p区由主族和0族元素组成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com