
| A. | 三处 | B. | 四处 | C. | 五处 | D. | 六处 |
分析 ①物质按照组成可以分纯净物和混合物,根据组成元素纯净物分为单质化合物;
②单质根据组成元素可分为金属单质和非金属单质;
③化合物主要包括:酸、碱、盐和氧化物
④按照分散质粒子直径大小可将分散系分为溶液、浊液和胶体
⑤根据化合价的变化判断;
⑥氧化还原反应和离子反应是交叉关系;
⑦氧化还原反应的本质是电子得失或共用电子对偏移;
⑧存在化合价变化的反应属于氧化还原反应.
解答 解:①物质按组成分为纯净物和混合物,纯净物按元素组成分为单质(仅一种元素组成的纯净物)和化合物(由两种或两种以上元素组成的纯净物),故①错误;
②由非金属元素形成的单质属于非金属单质,由金属元素形成的单质属于金属单质,所以单质分为金属单质和非金属单质,故②正确;
③根据无机化合物的构成元素以及化合物中的化学键可知,无机化合物主要包括酸、碱、盐和氧化物,故③正确;?
④按分散质粒子直径大小将分散系分为溶液、浊液和胶体,分散质粒子直径为1-100nm的是胶体,小于1nm的是溶液,大于100nm的是浊液,故④正确;?
⑤金属元素由化合态变为游离态,金属元素的化合价降低,所以被还原,故⑤正确;
⑥氧化还原反应与离子反应是交叉关系,按树状分类应为氧化还原反应和非氧化还原反应,故⑥错误;?
⑦氧化还原反应的本质是电子转移,化合价变化是氧化还原反应的特征,故⑦错误;
⑧存在化合价变化的反应属于氧化还原反应,有单质参加的化学反应不一定存在化合价的变化,不一定是氧化还原反应,如氧气转化为臭氧,有单质参加,但是不是氧化还原反应,故⑧错误.
故选B.
点评 本题考查了物质分类原则,氧化还原反应,电解质,重点要理解各概念的内涵和外延,比较基础,侧重对基础知识的巩固,注意对基础知识的理解掌握.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{m}{32}$ mol | B. | $\frac{2m}{64}$ mol | C. | $\frac{98n}{22.4}$ g | D. | $\frac{64n}{22.4}$g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
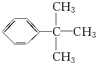 ;乙能被高锰酸钾酸性溶液氧化为分子式C8H6O4的羧酸,则乙可能的结构有9种.
;乙能被高锰酸钾酸性溶液氧化为分子式C8H6O4的羧酸,则乙可能的结构有9种. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热前称量时坩埚未完全干燥 | B. | 加热时间过长,晶体部分变黑 | ||
| C. | 加热过程中有少量晶体溅出 | D. | 在空气中冷却 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶、10mL量筒 | B. | 容量瓶、100mL量筒 | ||
| C. | 100mL容量瓶、50mL量筒 | D. | 100mL容量瓶、10mL量筒 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com