

| 6vn×10-3mol×56g/mol |
| mg |
| 0.336 |
| m |
| 33.6vn |
| m |
| 33.6vn |
| m |


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
A Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
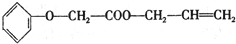 )的制备方法,据此回答问题:
)的制备方法,据此回答问题:
 (R-、R′-代表烃基)
(R-、R′-代表烃基) 的芳香族化合物有多种同分异构体,其中属于酯类,能使FeCl3溶液显紫色且苯环上的一氯代物只有两种的同分异构体的结构简式为
的芳香族化合物有多种同分异构体,其中属于酯类,能使FeCl3溶液显紫色且苯环上的一氯代物只有两种的同分异构体的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 T°C时,在一固定容积的密闭容器中发生反应:A(g)+B(g)?C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是( )
T°C时,在一固定容积的密闭容器中发生反应:A(g)+B(g)?C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是( )| A、T°C时,该反应的平衡常数值为4 |
| B、c点没有达到平衡,此时反应向逆向进行 |
| C、若c点为平衡点,则此时容器内的温度高于T°C |
| D、T°C时,直线cd上的点均为平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4 | B、5 | C、7 | D、8 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象或结论 |
| 步骤1:取少量固体样品溶于无氧蒸馏水中 | 固体完全溶解得无色澄清溶液 |
| 步骤2:加入过量盐酸 | |
| 步骤3: | 有白色沉淀产生,说明样品中含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图中每一个方框表示有关的一种反应物或生成物(部分生成物已省略),X是一种酸式盐,常用作化肥,加热分解生成A、B、C三种物质.其中A、C为无色气体,A能使澄清石灰水变浑浊,B在常温下是一种无色的液体.请填写下列空白:
如图中每一个方框表示有关的一种反应物或生成物(部分生成物已省略),X是一种酸式盐,常用作化肥,加热分解生成A、B、C三种物质.其中A、C为无色气体,A能使澄清石灰水变浑浊,B在常温下是一种无色的液体.请填写下列空白:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com