
| A. | 在组装蒸馏装置时,温度计的水银球应伸入液面下 | |
| B. | 用苯萃取溴水时有机层应从下口放出 | |
| C. | 在苯甲酸重结晶实验中,粗苯甲酸加热溶解后还要加少量蒸馏水 | |
| D. | 在苯甲酸重结晶实验中,待粗苯甲酸完全溶解后,要冷却到常温才过滤 |
分析 A.蒸馏时,测定馏分的温度;
B.苯萃取溴水时,有机层在上层;
C.水在加热过程中会蒸发,苯甲酸能溶于水;
D.温度高时苯甲酸的溶解度大,应减少苯甲酸的损耗.
解答 解:A.蒸馏时,测定馏分的温度,则温度计的水银球应在蒸馏烧瓶支管口处,故A错误;
B.苯萃取溴水时,有机层在上层,有机层应从上口倒出,故B错误;
C.水在加热过程中会蒸发,苯甲酸能溶于水,减少过滤时苯甲酸的损失,防止过饱和提前析出结晶,加热溶解后还要加少量蒸馏水,故C正确;
D.在苯甲酸重结晶实验中,待粗苯甲酸完全溶解后要趁热过滤,减少苯甲酸的损耗,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质及实验技能为解答的关键,侧重分析与实验能力的考查,注意苯甲酸的性质为解答的难点,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 用10mL量筒量取7.13mL稀盐酸 | |
| B. | 用酸式滴定管量取25.00ml稀硫酸 | |
| C. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| D. | 用托盘天平称量15.42gNaCl固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图所示,下列有关说法正确的是( )
瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图所示,下列有关说法正确的是( )| A. | 电池工作时,Na+向电极1移动 | |
| B. | 电池工作一段时间后停止,溶液PH值比开始时明显减小 | |
| C. | 电极1发生的电极反应为2NH3+6OH--6e-═N2↑+6H2O | |
| D. | 用该电池做电源电解精炼铜,理论上每消耗0.2 mol NH3的同时阳极会得到19.2g纯铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 相关实验 | 预期目的 | |
| ① | 将Fe投入硫酸铜溶液中; | 验证Fe的金属性比Cu强. |
| ② | 将氯水加入淀粉KI溶液中 | 验证Cl的非金属性比I强 |
| ③ | 在相同温度下,将表面积相同的铝条和镁条投入等体积同浓度的盐酸中,观察产生气泡的速率. | 比较同周期金属元素的金属性强弱. |
| ④ | 利用电解质溶液的导电性装置,检测AlCl3溶液的导电性 | 证明AlCl3是离子化合物 |
| A. | 仅④ | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中只有X是短周期的金属元素,下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中只有X是短周期的金属元素,下列判断正确的是( )| A. | X的最高价氧化物能不溶于强碱 | B. | 非金属性:T<R | ||
| C. | 气态氢化物稳定性:T>Z | D. | R与Q的原子核外电子数相差16 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Te原子的相对原子质量是127.5 | |
| B. | Te元素可能会有多种同位素 | |
| C. | Te原子5p亚层有2对成对电子 | |
| D. | Te原子最外层有6个运动状态相同的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=7的溶液中:Fe3+、NH4+、Cl-、N03- | |
| B. | 水电离出的c(H+)=$\sqrt{{k}_{w}}$的溶液中:Na+、S042-、C032-、K+ | |
| C. | 由水电离的c(OH-)=1×10-2mol•L-1的溶液中:Cl-、CH3COO-、K+、AlO2- | |
| D. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中:NH4+、Al3+、N03-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为37的氯原子:${\;}_{37}^{17}$Cl | B. | 乙醇的分子式:C2H4O | ||
| C. | 四氯化碳的电子式: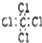 | D. | 异丁烷的结构简式:CH(CH3)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com