
下列关于元素周期表和元素周期律的说法正确的是
A.ⅥA族元素的原子半径越大,越容易得到电子
B.I A族与VIIA族元素间能形成离子化合物也能形成共价化合物
C.I A族元素的金属性比ⅡA族元素的金属性强
D.原子最外层电子数为2的元素一定位于元素周期表中的ⅡA族
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源:2014-2015学年内蒙古巴市高二10月月考化学试卷(解析版) 题型:填空题
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)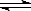 CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 。
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。在此温度下,若该容器中含有1molCO2、1.2molH2、0.75molCO、1.5molH2O,这状态 (填是或否)处于平衡状态?若不是,反应向哪个方向进行?
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期期中考试化学试卷(解析版) 题型:选择题
①①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O,
②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4。
下列结论正确的是
A.①②③均是氧化还原反应
B.氧化性强弱顺序是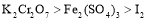
C.反应②中氧化剂与还原剂的物质的量之比为6:1
D.反应③中0.1mol还原剂共失去电子数为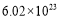
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列有关溶液组成的描述合理的是
A.0.1mol·L-1FeCl3溶液中能大量存在Fe2+、NH4+、SCN一、SO42-
B.酸性溶液中可能大量存在Na+、ClO一、SO42-、I—
C.碱性溶液中能大量存在Mg2+、Cu2+、SO42-、NO3—
D.加入铝粉能产生氢气的溶液中可能大量存在NH4+、Fe2+、SO42-、Cl一
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊市高三上学期期中考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.常温条件下,11.2L甲烷气体含甲烷分子数为0.5NA
B.标准状况下,22.4L Cl2通入水中,反应过程中转移电子数为NA
C.常温条件下,0.1mol·L-1的氢氧化钠溶液中含钠离子数为0.1NA
D.标准状况下,16g O2和O3的混合气体中含氧原子数为NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省盐城市高三第二次调研考试化学试卷(解析版) 题型:填空题
(12分)某化工集团为了提高资源利用率减少环境污染,将钛厂、氯碱厂和甲醇厂组成产业链。其主要工艺如下:
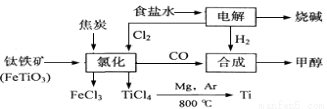
(1)写出工业上电解食盐水反应的化学方程式 。
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式: 。
(3)已知:①Mg(s) +Cl2(g)=MgCl2(s);ΔH=-641 kJ·mol-1
②Ti(s)+2Cl2(g)=TiCl4(s);ΔH=-770 kJ·mol-1
则2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s);ΔH= ,反应2Mg+TiCl4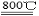 2MgCl4+Ti在Ar气氛中进行的理由是 。
2MgCl4+Ti在Ar气氛中进行的理由是 。
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中正极上的电极反应式是 ,负极区的pH (填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省盐城市高三第二次调研考试化学试卷(解析版) 题型:选择题
下列根据实验操作和现象所得出的结论错误的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2 min后,试管里出现凝胶 | 酸性:盐酸>硅酸 |
B | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点:氧化铝>铝 |
C | 常温下,向浓硫酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硫酸反应 |
D | 向某溶液中先滴加KSCN溶液,再滴加少量氯水 | 先无明显现象,后溶液变成血红色 | 溶液中含有Fe2+,没有Fe3+ |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省无锡市高三期中化学试卷(解析版) 题型:填空题
(12分)工业上用闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下:(已知Cd的金属活动性介于Zn和Fe之间)

(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为 。
(2)浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为 。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 。
该过程在空气入口处设计了一个类似淋浴喷头的装
置,其目的是 。
(4)置换法除去重金属离子Cd2+,所用物质C为 。
(5)取28.70 g ZnSO4·7H2O加热至不同温度,剩余固体的质量变化如图所示。
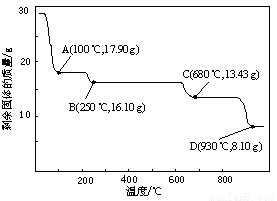
680℃时所得固体的化学式为 。
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4·H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省连云港市高三上学期期中化学试卷(解析版) 题型:填空题
(10分)原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子2p能级上有两个未成对电子;C的基态原子2p能级上的未成对电子数与A原子的相同;C2-与D+具有相同的电子层结构;E和C位于同一主族,F的原子序数为26。
(1)F原子基态的核外电子排布式为 。
(2)在A、B、C三种元素中,第一电离能由大到小的顺序是 (用元素符号回答)。
(3)元素A和B的气态氢化物比较, 的沸点特别高。(用化学式填写)
(4)元素A与E所形成晶体属于 晶体
(5)C、D两种元素形成的晶体中阴阳离子的个数比为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com