
高锰酸钾(KMnO4)和过氧化氢(H2O2)是两种典型的氧化剂。
(1)H2O2的结构式为________________。
(2)下列物质中能使酸性KMnO4溶液褪色的是________(填选项字母)。
A.臭碱(Na2S) B.小苏打(NaHCO3)
C.水玻璃(Na2SiO3) D.酒精(C2H5OH)
(3)高锰酸钾、双氧水、活性炭常用于饮用水的处理,但三者联合作用时必须有先后顺序。
①在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2-2e-―→2H++O2↑
还原反应:MnO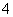 +5e-+8H+―→Mn2++4H2O
+5e-+8H+―→Mn2++4H2O
写出该氧化还原反应的离子方程式_____________________________
____________________________________________________________。
②在处理饮用水时,活性炭应在高锰酸钾反应结束后投加,否则会发生反应:KMnO4+C+H2O―→MnO2+X+K2CO3(未配平),其中X的化学式为________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
化学与社会、生产、生活密切相关,下列说法正确的是 ( )
A.澳大利亚学者研究发现,夏季给鸡喂食碳酸水会使蛋壳变厚
B.陶瓷、水泥及所有玻璃都是硅酸盐产品
C.绿色化学的核心是应用化学原理对环境污染进行治理
D.Cl2有漂白性,所以用Cl2可与石灰乳反应制备含氯消毒剂
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是 ( )
A.SO2水溶液能导电,所以SO2是电解质
B.Na2CO3既是钠盐又是碳酸盐
C.向醋酸溶液中加入少量氢氧化钠固体,由于发生中和反应,溶液的导电能力降低
D.NaCl溶液能导电所以NaCl溶液是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
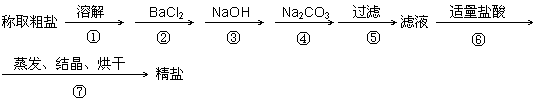
(1)判断BaCl2已过量的方法是 。
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)
(3)若先用盐酸再过滤,将对实验结果产生影响,其原因是
(4)在“粗盐提纯”的实验中,多次用到玻璃棒,在溶解、过滤、蒸发三个步骤中都用到玻璃棒,请写出步骤⑦使用到玻璃棒的作用__________ __
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
A.向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++H++OH-+SO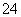 ===BaSO4↓+H2O
===BaSO4↓+H2O
B.用铜作电极电解硫酸溶液:2H2O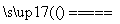 2H2↑+O2↑
2H2↑+O2↑
C.向NaClO溶液中通入过量SO2:ClO-+SO2+H2O===HClO+HSO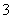
D.向AlCl3溶液中加入过量的Na:Al3++4Na+2H2O===AlO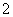 +4Na++2H2↑
+4Na++2H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,下列有关说法中不正确的是( )
A.d曲线代表溶液中Br-变化情况
B.原溶液中FeI2的物质的量为2 mol
C.原溶液中n(Fe2+):n(Br-)=2:3
D.当通入2 mol Cl2时,溶液中离子反应为2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.滴入酚酞显红色的溶液:Na+、Mg2+、NO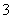 、HSO
、HSO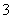
B.0.1 mol·L-1 Fe(NO3)2溶液:H+、Al3+、SO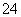 、Cl-
、Cl-
C.0.1 mol·L-1氨水溶液:K+、Na+、NO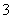 、AlO
、AlO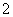
D.由水电离出的c(H+)=10-11 mol·L-1的溶液:Ca2+、NH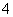 、Cl-、HCO
、Cl-、HCO
查看答案和解析>>
科目:高中化学 来源: 题型:
100 g炭粉燃烧所得气体中,CO占2/3、CO2占1/3,且C(s)+1/2O2(g)===CO(g) ΔH=-110.35 kJ/mol,CO(g)+1/2O2(g)===CO2(g) ΔH=-282.57 kJ/mol,与这些炭粉完全燃烧相比损失的热量是( )
A.784.92 kJ B.2 489.44 kJ
C.1 569.83 kJ D.3 274.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1 mol/L(此数值忽略水的电离及离子的水解)。
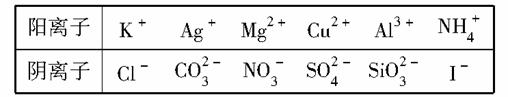
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ.用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ.另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是________。
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是________________。
(3)甲同学最终确定原溶液中所含阳离子有________,阴离子有______;并据此推测原溶液应该呈________性,原因是________________________
(请用离子方程式说明)。
(4)另取100 mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为________________。充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com