
| A. | A的式量比B大14 | |
| B. | B的式量比A大16 | |
| C. | 该酯中一定不含双键等不饱和键 | |
| D. | 酯、A、B三种物质的分子中都含一种相同的式量大于45的原子团 |
分析 由A可氧化得B,A如果表示为RCH2OH时,则B为RCOOH,酯可表示为:RCOOCH2R,可知B的式量比A大14,又因为该酯不能使溴的四氯化碳溶液褪色,说明该酯中烃基中一定不含碳碳双键等不饱和键.
解答 解:由A可氧化得B,A如果表示为RCH2OH时,则B为RCOOH,酯可表示为:RCOOCH2R.
A.B的式量比A大14,故A错误;
B.B的式量比A大14,故B错误;
C.又因为该酯不能使溴的四氯化碳溶液褪色,说明该酯的烃基一定不含碳碳双键等不饱和键,但酯基中含有不饱和键,故C错误;
D.酯的式量为212,则-R的式量为$\frac{212-24-32-2}{2}$=77,酯、A、B三种物质的分子中都含一种相同的式量大于45的原子团,故D正确,
故选:D.
点评 本题考查有机物结构确定,侧重考查学生分析推理能力,关键是确定醇的结构特点,注意掌握官能团的性质与转化,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用蓝色石蕊试纸检验溶液的酸性 | |
| B. | 量筒可用于配制溶液,但不能作为反应容器使用 | |
| C. | 配制稀硫酸时,先向烧杯中注入浓硫酸,再加水稀释 | |
| D. | 向燃着的酒精灯中加酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | … |
| … | C2H6 | C5H12 | C8H18 | … | … | … | … |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Ba2+、Cl-、NO3- | B. | K+、AlO2-、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
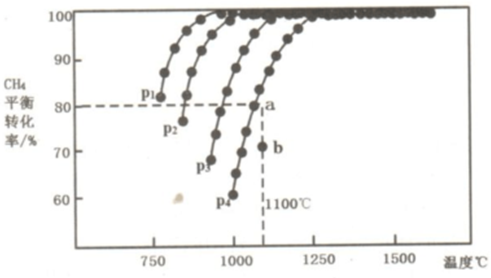
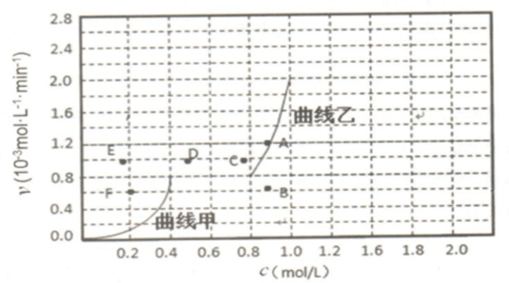
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com