
| A、不锈钢比生铁抗腐蚀能力强 | B、以铁为阴极、铜片为阳极、硫酸铜为电镀液可以实现铁制品镀铜 | C、铁与稀硫酸反应,铁与浓硫酸不能反应 | D、铁轨焊接时可以用铝热反应的方法制取少量的铁 |
| ||
| ||


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
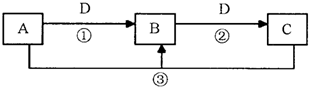
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
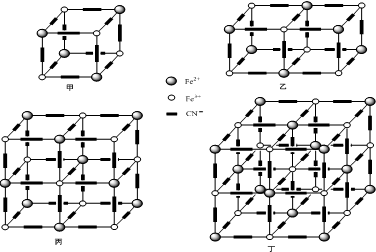
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验方案 | 实现现象 | 结论 |
| 1取一定量的合金粉末,加过量的 |
粉末部分溶解,并有气体放出. | 合金中一定含有 |
| ②取步骤①所得滤渣,加过量的 |
滤渣部分溶解,并有气体放出,溶液呈浅绿色. | 合金中一定含有 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省威海市高三下学期第一次模拟考试化学试卷(解析版) 题型:选择题
铁和铁合金是生产、生活中常用的材料,下列说法中错误的是
A.不锈钢比生铁抗腐蚀能力强
B.以铁为阴极、铜片为阳极、硫酸铜为电镀液可以实现铁制品镀铜
C.铁与稀硫酸反应,铁与浓硫酸不能反应
D.铁轨焊接时可以用铝热反应的方法制取少量的铁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com