
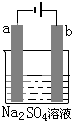
 图为直流电源电解1L 0.2mol/L的CuSO4水溶液的装置.通电一段时间后,b电极共收集到4.48L的气体(标准状况下),然后在石墨电极a和b附近分别滴加一滴石蕊试液,下列关于实验的叙述中不正确的是( )
图为直流电源电解1L 0.2mol/L的CuSO4水溶液的装置.通电一段时间后,b电极共收集到4.48L的气体(标准状况下),然后在石墨电极a和b附近分别滴加一滴石蕊试液,下列关于实验的叙述中不正确的是( )| A. | a电极的产物有Cu和H2 | |
| B. | 反应一段时间后,溶液的pH值变小 | |
| C. | a电极附近呈红色,b电极附近出现蓝色. | |
| D. | a、b电极转移的电子数为0.4mol |
分析 n(CuSO4)=0.2mol/L×1L=0.2mol,b为阳极、a为阴极,阳极电极反应式为4OH--4e-=2H2O+O2↑,b电极生成气体物质的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,转移电子的物质的量=0.2mol×4=0.8mol,阴极上铜离子完全析出时转移电子的物质的量=0.2mol×2=0.4mol<0.8mol,所以阴极上含有氢离子放电生成氢气,据此分析解答.
解答 解:n(CuSO4)=0.2mol/L×1L=0.2mol,b为阳极、a为阴极,阳极电极反应式为4OH--4e-=2H2O+O2↑,b电极生成气体物质的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,转移电子的物质的量=0.2mol×4=0.8mol,阴极上铜离子完全析出时转移电子的物质的量=0.2mol×2=0.4mol<0.8mol,所以阴极上含有氢离子放电生成氢气,
A.通过以上分析知,a电极的产物有Cu和H2,故A正确;
B.开始时电池反应式为2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,当铜离子完全析出时电池反应式为2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2H2↑,反应一段时间后有硫酸生成,所以溶液的pH值变小,故B正确;
C.a电极附近有氢氧根离子生成,溶液呈碱性,所以酚酞试液呈红色,b电极有无色气体生成,氢氧根离子放电溶液呈酸性,石蕊试液变红,故C错误;
D.通过以上分析知,a、b电极转移的电子数为0.8mol,故D错误;
故选CD.
点评 本题考查电解原理,明确阴极上电极反应式是解本题关键,注意:要通过转移电子相等判断阴极产物,为易错点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 戊二醛分子式为C5H10O2,符合此分子式的二元醛有4种 | |
| B. | 戊二醛不能在加热条件下和新制备的氢氧化铜反应 | |
| C. | 戊二醛不能使酸性KMnO4溶液褪色 | |
| D. | 对有机物分子红外光谱图的研究有助于确定有机物分子中的基团 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨汽化吸收大量的热,可用作制冷剂 | |
| B. | SO2具有还原性,可用作漂白剂 | |
| C. | 晶体硅熔点高硬度大,可用于制作半导体材料 | |
| D. | 常温下浓硫酸具有强氧化性,可用作脱水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 12gNaH中阴离子所含电子总数为NA | |
| B. | 60gSiO2含有的化学键数目为4NA | |
| C. | CO2通过Na2O2使其增重ag时,反应中转移的电子数为$\frac{a{N}_{A}}{56}$ | |
| D. | 常温常压下,14.9gKCl与NaClO的固体混合物中阴离子的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SiO3与SO2 | B. | Al2(SO4)3和 氨水 | C. | FeI2与Cl2 | D. | NaHCO3与Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2(SO4)3、(NH4)2SO4 | B. | NaAlO2、NH4Cl | C. | Al2(SO4)3、NH4Cl | D. | AgNO3、(NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78gNa2O2固体含有的离子数为4NA | |
| B. | 22.4L乙烯中含有的分子数为NA | |
| C. | 用惰性电极电解NaCl溶液,每生成agNaOH时,电路中通过的电子个数为aNA | |
| D. | 1molSiO2晶体中Si-O键数为4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com