
| A. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、ClO-、SO42-、SCN- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| C. | 由水电离产生的c(OH-)=1×10-13mol/L的溶液中:Ca2+、K+、Cl-、HCO3- | |
| D. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ |
分析 A.离子之间结合生成络离子;
B.$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液,显酸性;
C.由水电离产生的c(OH-)=1×10-13mol/L的溶液,为酸或碱溶液;
D.pH=1的溶液,显酸性.
解答 解:A.Fe3+、SCN-结合生成络离子,不能共存,故A不选;
B.$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液,显酸性,该组离子之间不反应,可大量共存,故B选;
C.由水电离产生的c(OH-)=1×10-13mol/L的溶液,为酸或碱溶液,均不能大量存在HCO3-,故C不选;
D.pH=1的溶液,显酸性,Fe2+、NO3-、H+发生氧化还原反应,不能共存,故D不选;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应的判断,题目难度不大.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:解答题
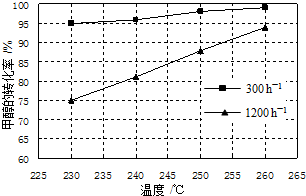 以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命.以甲醇为原料制取高纯H2是重要研究方向.
以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命.以甲醇为原料制取高纯H2是重要研究方向.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若忽略水的电离及H2CO3的第二级电离,则H2CO3?HCO3-+H+的平衡常数K1=4.2×10-7 | |
| B. | 少量Cl2通入到过量的Na2CO3溶液的离子方程式为Cl2+2CO32-+H2O═2HCO3-+Cl-+ClO- | |
| C. | Cl2与Na2CO3按物质的量之比1:1恰好反应的离子方程式为Cl2+CO32-+H2O═HCO3-+Cl-+HClO | |
| D. | 少量CO2通入到过量的NaClO溶液的离子方程式为2ClO-+CO2+H2O═CO32-+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向明矾溶液中加入少量的烧碱溶液:Al3++3OH-=Al(OH)3↓ | |
| B. | 在含有等物质的量的Fe(NO3)2和KI组成的混合溶液中滴入稀盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O | |
| C. | 碳酸氢铵溶液中滴加少量的NaOH溶液:HCO3-+OH-=CO32-+H2O | |
| D. | 硫化钠溶液呈碱性的原因:S2-+2H2O?H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴定次数 | 待测液体积(mL) | 标准硫酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.45 |
| 第二次 | 20.00 | 4.00 | 29.05 |
| 第三次 | 20.00 | 3.00 | 30.00 |
| 第四次 | 20.00 | 2.00 | 27.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲>乙>丙 | B. | 乙>甲>丙 | C. | 丙>甲>乙 | D. | 甲>丙>乙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com