
【题目】用NA表示阿伏德罗常数,下列叙述正确的是 ( )
A. 标准状况下,22.4LH2O含有的分子数为1 NA
B. 常温常压下,16g O2含有的原子数为1 NA
C. 通常状况下,1NA 个SO2分子占有的体积约为22.4L
D. 物质的量浓度为0.5mol/L的K2SO4溶液中,含有SO42-个数为0.5 NA
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 0.1 mol·L-1 NH4C1溶液加蒸馏水稀释,溶液的pH不断减小
B. 常温下,pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
C. NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则[Na+]= 2[![]() ]
]
D. 0.1 mol·L-1的NaHA溶液,其pH=4时:[HA-]>[H+]>[H2A]>[A2-]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】证明某溶液中不含Fe3+而可能含有Fe2+的实验操作如下:①加入足量新制氯水,②加入足量酸性高锰酸钾溶液,③加入少量硫氰化铵溶液,④加入氢氧化钠溶液。最佳的实验操作及顺序是( )
A.①③B.③②C.③①D.④①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断下列实验装置进行的相应实验,错误的是( )
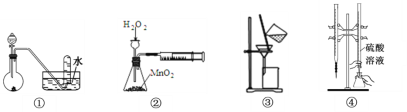
A. 用①图装置,进行H2O2分解制取少量O2的实验
B. 用②图装置,进行测定H2O2的分解速率的实验
C. 用③图装置,进行分离Fe(OH)3胶体和NaCl溶液的实验
D. 用④图装置,进行用已知浓度的硫酸溶液测定NaOH溶液浓度的实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应CO(g)+H2O(g)![]() CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
A. 加入催化剂,改变了反应的途径,反应的△H也随之改变
B. 改变压强,平衡不发生移动,反应放出的热量不变
C. 升高温度,反应速率加快,反应放出的热量不变
D. 若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO2(g) ![]() N2O4(g) ΔH<0)
N2O4(g) ΔH<0)
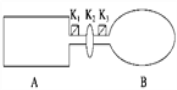
(1)一段时间后,反应达到平衡,此时A、B中生成N2O4的速率是vA______vB(填“>”、“<”或“=”);若打开活塞K2,气球B将______(填“变大”、“变小”或“不变”).
(2)关闭活塞K2,若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将________(填“增大”、“减小”或“不变”);若分别通入等量的氖气,则达到平衡时,A中NO2的转化率将________,B中NO2的转化率将______(填“变大”、“变小”或“不变”).
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,______中的颜色较深.
(4)若在容器A中充入4.6 g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素,在元素周期表中的位置如图所示,其中W元素的原子序数为Z元素原子序数的两倍,则下列说法正确的是
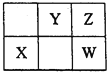
A. X位于元素周期表中的第3周期第ⅥA族
B. X、Y、Z三种元素对应原子的半径依次减小
C. XZ2和YZ2的结构和化学性质相似
D. 利用Y的含氧酸酸性强于W的含氧酸酸性,可证明非金属性W强于Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池构造如图所示。其电池反应方程式为: 2H2+O2=2H2O,下列说法不正确的是
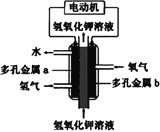
A. 多孔金属a作负极
B. 多孔金属b上,发生还原反应
C. 电池工作时,电解质溶液中OH移向a极
D. 正极的电极反应为:O2+4e+4H+=2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com