
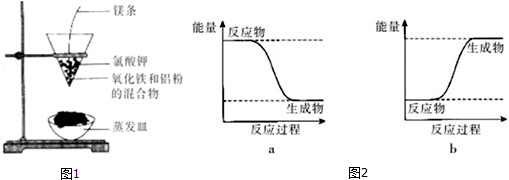
分析 加热条件下,铝和氧化铁反应生成氧化铝和铁,为置换反应,反应中生成熔融物,说明金属熔化,应为放热反应,以此解答该题.
解答 解:反应剧烈,漏斗下方有红热熔融物流出,说明该反应为放热反应,方程式为:Fe2O3+2Al $\frac{\underline{\;高温\;}}{\;}$Al2O3+2 Fe,反应物总能量大于生成物总能量,所以可用图2中的a表示;
故答案为:Fe2O3+2Al $\frac{\underline{\;高温\;}}{\;}$Al2O3+2 Fe; a;分解产生氧气,使镁条充分燃烧放出大量热.
点评 本题考查化学反应的热量变化,为高频考点,侧重于学生的分析能力和实验能力的考查,学生应注重归纳中学化学中常见的吸热或放热的反应,对于特殊过程中的热量变化的要熟练记忆来解答此类习题.


科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁与盐酸反应OH-+H+═H2O | |
| B. | 用稀硫酸清除铁锈Fe2O3+6H+═2Fe3++3H2O | |
| C. | 食盐水中滴加硝酸银溶液Cl-+Ag+═AgCl↓ | |
| D. | 氢氧化钡跟硫酸铜溶液的反应Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
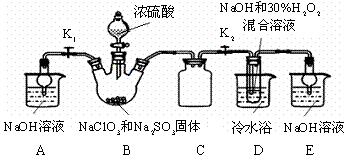
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
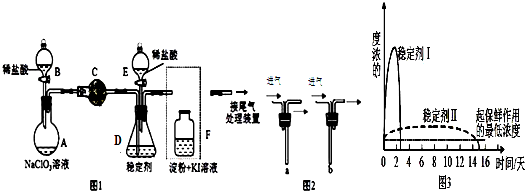
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com