
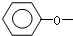
 >HCO3-.
>HCO3-.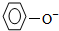 >HCO3-,故④正确;
>HCO3-,故④正确;

科目:高中化学 来源: 题型:
 (2009?淮安二模)锰酸锂离子蓄电池是第二代锂离子动力电池.它的问世使得锂离子动力电池在纯电动汽车与混合动力车等大型蓄电池应用领域占据主导地位.电池反应式为:Li1-xMnO4+LixC=LiMnO4+C,下列有关说法不正确的是( )
(2009?淮安二模)锰酸锂离子蓄电池是第二代锂离子动力电池.它的问世使得锂离子动力电池在纯电动汽车与混合动力车等大型蓄电池应用领域占据主导地位.电池反应式为:Li1-xMnO4+LixC=LiMnO4+C,下列有关说法不正确的是( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com