
【题目】
Ⅰ.对于可逆反应CO+H2O(g)![]() CO2+H2,回答下列问题:
CO2+H2,回答下列问题:
(1)830 K时,若起始时c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,平衡时CO的转化率为60%,水蒸气的转化率为 _____________;平衡常数K的值为 _____________。
(2)830 K时,若只将起始时c(H2O)改为6 mol·L-1,则水蒸气的转化率为_____________ 。
(3)若830 K时,某时刻混合体系中各气体的浓度为c(CO2)=0.4 mol·L-1c(CO)=0.6 mol·L-1c(H2O)=3 mol·L-1,c(H2)=2 mol·L-1请判定该体系中反应进行的方向:______________ (填“正向进行”“逆向进行”或“达到平衡”)。
Ⅱ恒温恒压下,在一个容积可变的容器中发生如下反应:A(g)+B(g) ![]() C(g)
C(g)
(1)若开始时放入1mol A和1mol B,达到平衡后,生成a mol C,这时A的物质的量为 _______ mol。
(2)若开始时放入3mol A和3mol B,达到平衡后,生成C的物质的量为 _______mol。
(3)若开始时放入x mol A2mol B和1mol C,达到平衡后,A和C的物质的量分别为y mol和3a mol,则x= ______,y= _________。
(4)若在(3)的平衡混合物中再加入3mol C,待再次达到平衡后,C的物质的量分数是 _______。
【答案】40% 1 25% 正向进行 1-a 3a 2 3-3a ![]()
【解析】
Ⅰ.(1)根据CO的起始浓度和转化率可以计算CO的转化浓度,列三段式求出平衡时各物质的物质的量浓度,从而计算水蒸气的转化率和平衡常数K;
(2)设CO的转化浓度为x,列出三段式,根据一定温度下反应的平衡常数不变解出x,据此分析;
(3)计算此时反应的浓度商,并与平衡常数进行比较判断反应进行的方向。
Ⅱ.(1)依据化学平衡的三段式列式计算;
(2)根据恒温、恒压下放入3molA和3molB,与(1)建立等效平衡进行分析;
(3)恒温、恒压下根据生成的C为3a mol可知,达到的平衡与起始量加入3molA、3molB所达到的平衡是相同的平衡,依据(2)的分析计算得到(3)的X、Y的取值;
(4)再加3molC折算成A和B,相当于6molA和6molB,由于是恒压过程,此时与(1)中的平衡为等效平衡,且是成比例等效,据此可以解题。
Ⅰ.(1)若起始时,c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,平衡时CO的转化率为60%,列出三段式为: CO+H2O(g)![]() CO2+H2
CO2+H2
起始量(mol/L) 2 3 0 0
变化量(mol/L) 1.2 1.2 1.2 1.2
平衡量(mol/L) 0.8 1.8 1.2 1.2
则水蒸气的转化率为![]() ;平衡常数K的值为
;平衡常数K的值为![]() ;
;
答案为:40%;1;
(2)温度不变,平衡常数不变,设CO的转化浓度为x,据此列出三段式进行计算:
CO+H2O(g)![]() CO2+H2
CO2+H2
起始量(mol/L) 2 6 0 0
变化量(mol/L) x x x x
平衡量(mol/L) 2-x 6-x x x
则平衡常数![]() ,解得x=1.5mol/L,
,解得x=1.5mol/L,
则水蒸气的转化率为![]() ;
;
故答案为:25%;
(3)此时该反应的浓度商为![]() ,则反应正向进行;
,则反应正向进行;
故答案为:正向进行;
Ⅱ.(1)根据化学平衡三段式列式计算
A(g)+B(g)C(g)
起始量(mol) 1 1 0
变化量(mol) a a a
平衡量(mol) 1a 1a a
则A的物质的量为(1a)mol;
故答案为:1-a;
(2)在恒温恒压条件下,若开始时放入3mol A和3mol B,同等程度改变反应物的用量,A、B物质的量之比也为1:1,将建立与(1)等效的平衡状态,所以到达平衡后,依据(1)中的计算可知,生成C的物质的量为3a mol;
故答案为:3a;
(3)恒温、恒压下到达平衡后,C的物质的量为3a mol,说明与(2)所达到的平衡是完全相同的平衡状态,则满足极值转化后A、B起始量分为3mol、3mol,则有
A(g)+B(g) C(g)
起始量(mol) x 2 1
极值转化(mol) x+1 2+1=3
则x+1=3,x=2;
因为极值转化后A、B起始量分为3mol、3mol,与(1)中A、B的物质的量之比均为1:1,则为等效平衡,平衡时转化率相同,各物质的量均是A中的3倍,则平衡时A的物质的量为y=3(1-a)mol=3-3a mol;
故答案为:2;3-3a;
(4)再加3molC折算成A和B,相当于起始加入6mol A和6mol B,由于是恒压过程,此时与(1)中的平衡为等效平衡,且是成比例等效,
A(g)+B(g)C(g)
起始量1(mol) 1 1 0
平衡量1(mol) 1a 1a a
起始量2(mol) 6 6 0
平衡量2(mol) 66a 66a 6a
C的物质的量分数为![]() ;
;
故答案为:![]() 。
。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
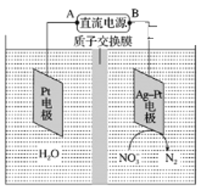
【题目】(1)催化硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化硝化法中,用H2将NO3—还原为N2,一段时间后,溶液的碱性明显增强。则该反应离子方程式为____。
②电化学降解NO3—的原理如图所示,电源正极为________(填“A”或 B”),若总反应4NO3-+4H+=5O2+2N2+2H2O,则阴极反应式为_______。
③能否把质子交换膜改为阴离子交换膜____________(填“能“或”不能”)。
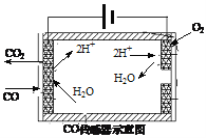
(2)研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
①CO与O2设计成燃料电池(以KOH溶液为电解液)。该电池的负极反应式为______。
②测量汽车尾气中的CO浓度常用电化学气敏传感器,可用图简单表示,则阳极发生的电极反应为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,不能通过一步反应实现如图所示转化的是( )
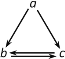
物质 选项 | a | b | c |
A. | AlCl3 | Al(OH)3 | NaAlO2 |
B. | HNO3 | NO | NO2 |
C. | Si | SiO2 | Na2SiO3 |
D. | Fe | FeCl2 | FeCl3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃时,下列反应的平衡常数如下:
①N2(g)+O2(g)![]() 2NO(g) K1=1×10-30
2NO(g) K1=1×10-30
②2H2(g)+O2(g)![]() 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
③2CO2(g)![]() 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
下列说法正确的是
A.NO分解反应NO(g)![]()
![]() N2(g)+
N2(g)+![]() O2(g)的平衡常数为1×10-30
O2(g)的平衡常数为1×10-30
B.根据K2的值可以判断常温下H2和O2很容易反应生成H2O
C.常温下,NO、H2O、CO2三种物质分解放出O2的倾向顺序为NO>H2O>CO2
D.温度升高,上述三个反应的平衡常数均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
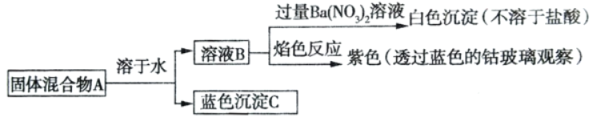
A.固体混合物 A 是 CuSO4 和 NaOH
B.固体混合物 A 是 CuSO4 和 KOH
C.固体混合物 A 是 CuCl2 和 KOH
D.固体混合物 A 是 CuSO4 和 Ba(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。

(1)利用B装置可制备的气体有________________(写出一种即可)。
(2)若装置A、C、E相连后用于制取Cl2,写出A中发生的离子方程式_____________。 若要收集到纯净干燥的氯气,需要在装置A、C之间增加两个装有____________和_______的洗气瓶(填写试剂的名称)。
(3)若装置A、C、E相连后用于制取SO2,尾气吸收时容易发生倒吸现象,改进措施为__________________________。
(4)若装置B、D、E相连后可制得NO2并进行有关实验。欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹____________,再打开止水夹_____________,微热试管丁使烧杯中的水进入丁中,充分反应后,若向试管中通入一定量的氧气至试管内完全充满液体,则所得溶液中溶质的物质的量浓度是__________________ mol/L(气体按标准状况计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能够水解的某有机化合物A经李比希法测得其中含碳为72.0%、含氢为6.67%,其余全为氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知A的相对分子质量为150。
方法二:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为1∶2∶2∶2∶3,如图1。
方法三:利用红外光谱仪测得A分子的红外光谱如图2。


试填空:
(1)A的分子式为__。
(2)A的分子中只含一个甲基的依据是__(填字母)。
a.A的相对分子质量
b.A的分子式
c.A的核磁共振氢谱图
d.A分子的红外光谱图
(3)A可能的结构简式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M(C16H14O2)是一种香料,工业上利用烃A和甲苯为主要原料,按下列路线合成:
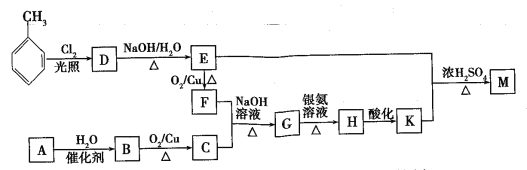
已知:①气态烃A在标准状况下的密度是1.25g/L,能作为果实催熟剂;②醛在碱性溶液中能发生羟醛缩合反应,再脱水生成不饱和醛:RCH2CHO+ 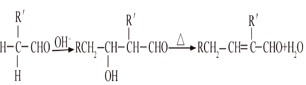 。请回答下列问题:
。请回答下列问题:
(1)K的名称是___________;G中含有的官能团名称是______________。
(2)写出D→E的化学方程式____________________________________。
(3)A→B的反应类型是_______;
(4)同时满足下列三个条件的K的同分异构体有_____种(不考虑立体异构)。①遇FeCl3溶液发生显色反应;②能发生银镜反应;③除苯环以外不再含有其他环状结构。其中核磁共振氢谱为五组峰的结构简式为____。
(5)以乙醇为起始原料,选用必要的无机试剂设计合成1-丁烯的路线。(用结构简式表示有机物,箭头上注明试剂和反应条件)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO | |
电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 | |
回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是________________;(填编号)
a.CO32- b.ClO- c.CH3COO- d.HCO3-;
(2)下列反应不能发生的是__________
A.CO32- + CH3COOH = CH3COO- + CO2 ↑ + H2O
B.ClO- + CH3COOH = CH3COO- + HClO
C.CO32- + HClO = CO2 ↑ + H2O + ClO-
D.2 ClO- + CO2 + H2O = CO32-+ 2 HClO
(3)用蒸馏水稀释0.10 mol·L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是__________
A.c(CH3COOH)/c(H+) B.c(CH3COO-)/c(CH3COOH)
C.c(H+)/ KW D.c(H+)/c(OH-)
(4)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化 如图,则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)________醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或“小于”)
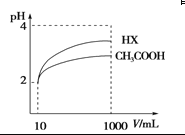
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com