
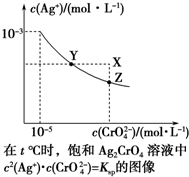
 已知t℃时AgCl的Ksp=4×10-10,在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( )
已知t℃时AgCl的Ksp=4×10-10,在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( )| A. | 在t℃时,Ag2CrO4的Ksp为1×10-11 | |
| B. | 在饱和溶液中加入K2CrO4(s)可使溶液由Y点到Z点 | |
| C. | 在t℃,Ag2CrO4(s)+2Cl-(aq)?2AgCl(s)+CrO${\;}_{4}^{2-}$(aq)平衡常数K=6.25×107 | |
| D. | 在t℃时,以0.001 mol•L-1 AgNO3溶液滴定20 mL 0.001 mol•L-1 KCl和0.001 mol•L-1的K2CrO4的混合溶液,CrO${\;}_{4}^{2-}$先沉淀 |
分析 A.曲线上的点是沉淀溶解平衡,溶度积是饱和溶液中离子浓度幂次方的乘积;
B.在饱和溶液中加入K2CrO4(s),c(CrO42-)增大,平衡逆向移动;
C.依据银离子浓度相同时氯化银的溶度积和Ag2CrO4(橘红色)的溶度积计算得到平衡常数;
D.依据溶液中离子浓度结合溶度积常数计算银离子浓度,银离子浓度越小先析出沉淀.
解答 解:A.曲线上的点是沉淀溶解平衡,Ag2CrO4的沉淀溶剂平衡为:Ag2CrO4(s)?2Ag++CrO42-,Ksp=c2(Ag+)c(CrO42-)=(10-3)2•10-5=10-11,故A正确;
B.在饱和溶液中加入K2CrO4可使沉淀溶解平衡左移,溶积常数不变,还是饱和溶液,点应在曲线上,故B正确;
C.在t℃时,Ag2CrO4(s)+2Cl-(aq?2AgCl(s)+CrO42-(aq);离子浓度相同时氯化银的溶度积和Ag2CrO4(橘红色)的溶度积计算,K=$\frac{c(Cr{{O}_{4}}^{2-})}{{c}^{2}(C{l}^{-})}$=$\frac{{K}_{sp}(A{g}_{2}Cr{O}_{4})}{{{K}_{sp}}^{2}(AgCl)}$$\frac{1{0}^{-11}}{(4×1{0}^{-10})^{2}}$=6.25×107;故C正确;
D.依据溶度积常数计算Ksp(CrO42-)=c2(Ag+)c(CrO42-)=1×10-9 ;Ksp(AgCl)=c(Ag+)c(Cl-)=4×10-10,以0.001mol/L AgNO3溶液滴定20mL0.001mol/L KCl和0.001mol/L的K2CrO4的混合溶液,c(CrO42-)=0.001mol/L,得到c(Ag+)=$\sqrt{\frac{1×1{0}^{-9}}{1{0}^{-3}}}$=1×10-3mol/L;0.001mol/L KCl溶液中,c(Cl-)=0.001mol/L;依据溶度积计算得到:(Ag+)=$\frac{4×1{0}^{-10}}{1{0}^{-3}}$=4×10-7mol/L;所以先析出氯化银沉淀,故D错误;
故选D.
点评 本题考查沉淀溶解平衡,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意理解难溶电解质在水中的沉淀溶解平衡特点,正确理解和掌握溶度积KSP的概念.


科目:高中化学 来源: 题型:选择题
| A. | Na2CO3浓度减小 | B. | Na2CO3浓度增大 | ||
| C. | Na2CO3浓度增大,并有晶体析出 | D. | Na2CO3浓度不变,并有晶体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
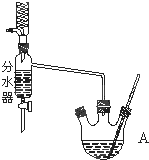 如图为制取乙酸乙酯的实验装置图.回答下列问题:
如图为制取乙酸乙酯的实验装置图.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10).
NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10).| 滴定次数 | 待测溶液A的体积(/mL) | 0.1000mol•L-1NaOH溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10ml | B. | 5ml | C. | 大于5ml | D. | 小于5ml |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱式滴定管只用水洗,而未用待测液润洗 | |
| B. | 锥形瓶中残留有蒸馏水 | |
| C. | 酸式滴定管滴定前尖嘴处有气泡,滴定后气泡消失 | |
| D. | 滴定前仰视刻度读数,滴定后俯视刻度读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学学习小组的同学 依据氧化还原反应:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,可采用滴定的方法测定FeSO4的质量分数,实验步骤如下:
某化学学习小组的同学 依据氧化还原反应:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,可采用滴定的方法测定FeSO4的质量分数,实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 密度 | 沸点 | 溶解性 | ||
| 丙烯酸 | 1.05g/cm3 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
| 甲醇 | 0.79g/cm3 | 64.7℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
| 丙烯酸甲酯 | 0.95g/cm3 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 易挥发 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com