
分析 (1)25℃时,0.1mol/L的HA溶液中c(H+)/c(OH-)=1010,c(H+).c(OH-)=10-14,则溶液中c(H+)=0.01mol/L<0.1mol/L;
(2)HA是弱电解质,加水稀释促进HA电离,但HA电离增大程度小于溶液体积增大程度,所以c(H+)、c(HA)、c(A-)都减小,温度不变,水的离子积常数不变;
(3)NaA溶液中因为A离子的水解使溶液显碱性.
解答 解:(1)25℃时,0.1mol/L的HA溶液中c(H+)/c(OH-)=1010,c(H+).c(OH-)=10-14,则溶液中c(H+)=0.01mol/L<0.1mol/L,说明HA在水溶液里部分电离,则为弱电解质,
故答案为:弱电解质;
(2)HA是弱电解质,加水稀释促进HA电离,但HA电离增大程度小于溶液体积增大程度,所以c(H+)、c(HA)、c(A-)都减小,温度不变,水的离子积常数不变,
A.加水稀释促进HA电离,则n(H+)增大、n(HA)减小,溶液体积相同,所以其比值增大,故A正确;
B.加水稀释促进HA电离,则n(HA)减小、n(A-)增大,所以其比值减小,故B错误;
C.温度不变,则c(H+)与c(OH-)的乘积不变,故C错误;
D.温度不变,则c(H+)与c(OH-)的乘积不变,加水稀释c(H+)减小,则c(OH-)增大,故D正确;
故答案为:AD;
(3)HA是弱酸,在NaA中水解导致溶液显碱性,水解的离子方程式为A-+H2O?HA+OH-,
故答案为:碱性;A-+H2O?HA+OH-.
点评 本题考查了水的电离及其影响因素、电解质强弱判断、弱电解质电离,题目难度中等,注意掌握水的电离及影响因素,明确酸碱溶液抑制了水的电离,温度不变,水的离子积不变.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H6和2-甲基1-丁烯 | |
| B. | 3,3-二甲基-1-丁炔和3-甲基1-戊炔 | |
| C. |  和 和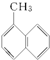 | |
| D. | C4H10和C9H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径由大到小的顺序:Z、X、Y | |
| B. | 元素非金属性由强到弱的顺序:W、Z、Y | |
| C. | 简单气态氢化物的稳定性由强到弱的顺序:Z、W | |
| D. | W分别与X、Y形成的化合物化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备Fe(OH)3胶体:0.1 mol•L-1 FeCl3溶液与0.3 mol•L-1 NaOH溶液等体积混合 | |
| B. | 验证溴原子:取C2H5Br少许与NaOH溶液共热,冷却后滴加AgNO3溶液 | |
| C. | 检验Fe2+:取少量待测液,向其中加入适量新制氯水,再滴加KSCN溶液 | |
| D. | 比较AgCl和AgI的溶解度:向2 mL 0.1 mol•L-1 NaCl溶液中滴加数滴同浓度AgNO3溶液,然后再滴入KI溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ Ag+ NO3- Cl- | B. | Mg2+NH4+ NO3- I- | ||
| C. | Ba2+K+ S2- Cl- | D. | Zn2+ Na+ NO3- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙酸都是常用调味品的主要成分 | |
| B. | 相同条件下,与金属钠反应的速率,乙醇比乙酸慢 | |
| C. | 乙醇可由乙烯与水发生加成反应制得,乙酸可由乙醇氧化制得 | |
| D. | 乙醇和乙酸之间能发生酯化反应,酯化反应的逆反应为皂化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com