
| A. | NH5中既有共价键又有离子键 | |
| B. | NH5的电子式为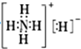 | |
| C. | 1 mol NH5中含有5NA个N-H键(NA表示阿伏加德罗常数) | |
| D. | 它与水反应的离子方程式为NH4++H-+H2O═NH3•H2O+H2↑ |
分析 固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体的最外电子层结构,则存在H-和NH4+,应为NH4H,是一种离子化合物,能与水反应:NH4H+H2O=NH3•H2O+H2↑,有氨气生成,据此解答.
解答 解:A.NH5中存在铵根离子和H-,为离子化合物,铵根离子中含N-H共价键,故A正确;
B.NH5中存在铵根离子和H-,电子式为: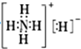 ,故B正确;
,故B正确;
C.NH5中存在铵根离子和H-,为离子化合物,铵根离子中含N-H共价键,1mol NH5中含有4mol N-H键,故C错误;
D.NH5与水反应:NH4H+H2O=NH3•H2O+H2↑,离子方程式:NH4++H-+H2O═NH3•H2O+H2↑,故D正确;
故选:C.
点评 本题考查NH5的组成和性质,利用信息得出物质的结构为解答的关键,注意离子键与共价键区别,题目难度中等.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:解答题
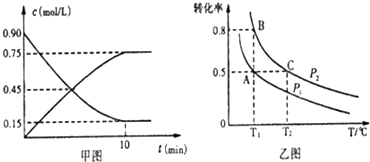 硫及其化合物有广泛应用.
硫及其化合物有广泛应用.| NH3•H2O | H2SO3 | ||
| 电离平衡常数为 (mol•L-1) | 1.7×10-5 | Ka1 | Ka2 |
| 1.54×10-2 | 1.02×10-7 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用可见光束照射以区别溶液和胶体 | |
| B. | 用萃取分液的方法出去酒精中的水 | |
| C. | 通过盛有酸性高锰酸钾的洗气瓶除去甲烷中的乙烯 | |
| D. | 只滴加氨水鉴别NaCl MgCl2 AlCl3 Na2SO4 四种无色溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸与水 | B. | 氯化钠与水 | C. | 熟石灰与水 | D. | 生石灰与水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒压下充入稀有气体 | B. | 减小反应容器的体积 | ||
| C. | 升高反应温度 | D. | 分离出生成物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
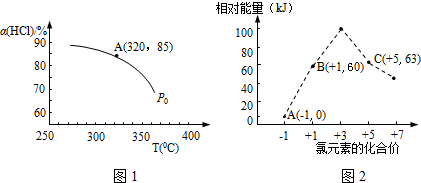
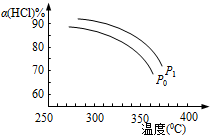 ,增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.
,增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com