
(14分)碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。
(1)合成该物质的步骤如下:
步骤1:配制0.5 mol·L-1MgSO4溶液和0.5 mol·L-1NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL三口烧瓶中,开启搅拌器。温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完后,用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤、洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得碳酸镁晶须产品(MgCO3·nH2O n=1~5)。
回答下列问题:
步骤3中加氨水后的离子方程式 。
(2)测定合成的MgCO3·nH2O中的n值。称量1.000 g碳酸镁晶须,放入如图所示的广口瓶中加入水滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,反应后期将温度升到30 ℃,最后的烧杯中的溶液用已知浓度的盐酸滴定,测得CO2的总量;重复上述操作2次。


①图中气球的作用是 。
②上述反应后期要升温到30℃,主要目的是 。
③用已知浓度的盐酸滴定烧杯中的溶液时应选用 为指示剂,若盛放盐酸的滴定管在滴定前有气泡未排尽,滴定后无气泡(其他操作均正确),则所测CO2的量会 (填“偏大”“偏小”“无影响”)
④设3次实验测得每1.000 g碳酸镁晶须与稀硫酸反应产生的CO2平均值为a mol,则n值为 (用含a的表达式表示)。
(3)称取100 g上述晶须产品进行热重分析,热重曲线如图。则该条件下合成的晶须中,n= (选填1、2、3、4、5)。
(1) NH3·H2O+Mg2++HCO ===MgCO3↓+NH
===MgCO3↓+NH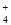 +H2O
+H2O
(2)①暂时储存CO2,有利于CO2被NaOH溶液吸收,且能保持装置中压强相对稳定
②使溶解在水中的CO2逸出,便于吸收 ③甲基橙,偏大 ④(1-84a)/18a (3)1
【解析】
试题分析:(1)氨水是弱碱,与碳酸氢镁反应的离子方程式为NH3·H2O+Mg2++HCO ===MgCO3↓+NH
===MgCO3↓+NH +H2O。
+H2O。
(2)①装置中气球可以暂时储存CO2,有利于CO2被NaOH溶液吸收,且能保持装置中压强相对稳定。②反应后期将温度升到30℃,使生成的二氧化碳全部逸出后被氢氧化钠溶液吸收,减少测定产生的误差。
③用盐酸滴定时,反应后溶液显酸性,因此应该选择甲基橙作指示剂。若盛放盐酸的滴定管在滴定前有气泡未排尽,滴定后无气泡(其他操作均正确),则导致消耗盐酸溶液的体积增加,从而使所测CO2的量会偏大。
④实验测得每1.000g碳酸镁晶须产生的CO2平均值为a mol,依据元素守恒可知,碳酸镁物质的量为amol,根据化学式可知,MgCO3?nH2O中碳酸镁晶体中碳酸镁和结晶水物质的量之比为1:n,得到1:n=a: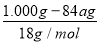 ;得到n=(1-84a)/18a。
;得到n=(1-84a)/18a。
(3)MgCO3?nH2O中n=1~5,分析图象400°C剩余质量为82.3g,为失去结晶水的质量,剩余质量为39.2g是碳酸镁分解失去二氧化碳的质量,得到100g×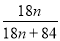 =100-82.3,n=1。
=100-82.3,n=1。
考点:考查物质制备实验方案的设计和分析判断


科目:高中化学 来源:2013-2014江苏省海门市第一学期期末教学质量调研高一化学试卷(解析版) 题型:选择题
有NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,用一种试剂就可把它们鉴别开来,这种试剂是
A.盐酸 B.氨水 C.烧碱溶液 D.KSCN溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省无锡市高一下学期期末考试化学试卷(解析版) 题型:选择题
下列装置或操作能达到实验目的的是
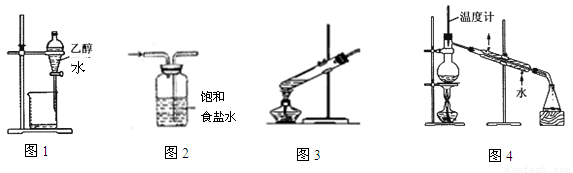
A.分离乙醇和水 B.除去氯气中的氯化氢 C.葡萄糖的银镜反应 D.石油的蒸馏
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高一期末模拟化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.钠与水反应:Na+H2O=Na++OH-+H2↑
B.硫酸铜溶液与氢氧化钡溶液反应:Ba2+ + SO42- =BaSO4↓
C.氨水和硫酸铝溶液反应:3OH-+ Al3+ =Al(OH)3↓
D.二氧化硅与氢氧化钠溶液反应 SiO2+2OH-=SiO32-+H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高一期末模拟化学试卷(解析版) 题型:选择题
能证明硅酸的酸性弱于碳酸酸性的实验事实是
A.CO2溶于水形成碳酸,SiO2难溶于水
B.CO2通入可溶性硅酸盐中析出硅酸沉淀
C.高温下SiO2与碳酸盐反应生成CO2
D.HCl通入可溶性碳酸盐溶液中放出气体,氯化氢通入可溶性硅酸盐溶液中生成沉淀
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:选择题
T ℃时,某NaOH溶液中c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T ℃),测得混合溶液的部分pH如表中所示:
序号 | NaOH溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 20.00 | 0.00 | 8 |
② | 20.00 | 20.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则c为
A.3 B.4 C.5 D.6
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:选择题
要使金属晶体熔化必须破坏其中的金属键。金属晶体熔、沸点高低和硬度大小一般取决于金属键的强弱。由此判断下列说法正确的是
A.金属镁的熔点高于金属铝
B.碱金属单质的熔、沸点从Li到Cs是逐渐升高的
C.金属镁的硬度小于金属钙
D.金属铝的硬度大于金属钠
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高三模拟考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.镀锌铁板是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的
B.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,说明BaCl2溶液显酸性
C.合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动
D.汽车尾气的净化反应2NO+2CO 2CO2+N2 △H<0,则该反应一定能自发进行
2CO2+N2 △H<0,则该反应一定能自发进行
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三第三次模拟考试化学试卷(解析版) 题型:选择题
只用下表提供的仪器、试剂,就能达到相应实验目的的是( )
选项 | 仪器 | 试剂 | 相应实验目的 |
A | 托盘天平(带砝码)、滴管、量筒、烧杯、药匙、玻璃棒 | 食盐,蒸馏水 | 配制一定物质的量浓度的NaCl溶液 |
B | 烧杯、漏斗、滴管、铁架台(带铁圈)、玻璃棒、滤纸、导气管 | AlCl3溶液(含少量MgCl2),烧碱,CO2,稀盐酸 | 除去AlCl3溶液中少量的MgCl2 |
C | 酸式滴定管、滴管、铁架台(带铁夹) | 已知浓度的盐酸,未知浓度的NaOH溶液 | 测定NaOH溶液的浓度 |
D | 分液漏斗、烧瓶、锥形瓶、导管、橡皮塞 | 稀盐酸,大理石,硅酸钠溶液 | 证明非金属性:Cl>C>Si |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com